3 частини: Визначення обмежує реагентаРасчет теоретичного виходу продуктаРасчет відсотка виходу
У хімії, виходом реакції називають ту кількість продукту, яке виходить після хімічної реакції. Теоретичний вихід - це максимальна кількість отриманого продукту в умовах максимально ефективної реакції. В реальності ж, більшість реакцій не є максимально ефективними - дійсний вихід реакції найчастіше значно менше, ніж її теоретичний вихід. Для вираження ефективності реакції підрахуйте відсоток виходу. використовуючи цю формулу:% виходу = (дійсний вихід / теоретичний вихід) x 100.
Частина 1 з 3: Визначення обмежує реагенту
- 1 Почніть з записування збалансованого хімічного рівняння. Це допоможе вам висловити в математичній формі вашу майбутню реакцію.
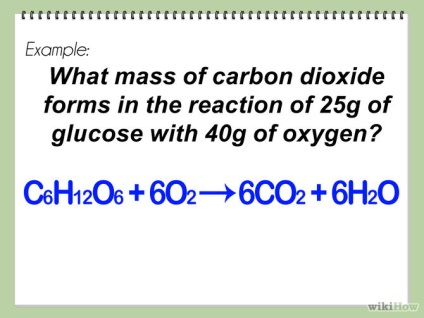
- Якщо ви не впевнені як записати або збалансувати хімічне рівняння, то прочитайте статтю wikiHow: Як записати хімічне рівняння і збалансувати його.
- 2 Визначте використовувані реагенти. Вони записуються, найчастіше, з лівого боку від стрілки в хімічному рівнянні. Їх також називають «початковий матеріал». У вас може бути (як наприклад, в частині 2) всього один реагент.

- Цифри поруч з вашими реагентами, якщо вони є, називаються коефіцієнтами. Вони показують співвідношення, в якому використовуються ваші реагенти.
- Граничний реагент - це початковий матеріал, який закінчиться першим. В реакції, в якій присутні кілька вихідних матеріалів, якщо ви не використовуєте всі початкові матеріали однакового молярного кількості в співвідношенні 1: 1 одна одній, то один з реагентів закінчиться першим, що зупинить проходження реакції.
- 3 Порахуйте кількість (в молях) кожного реагенту. Для цього, розділіть масу реагенту на його ж молярну масу.
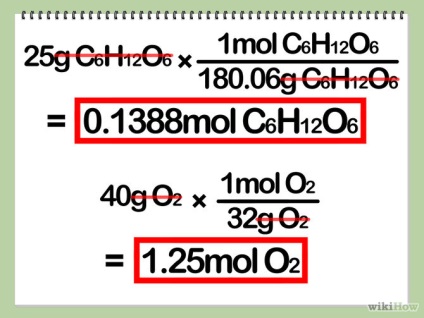
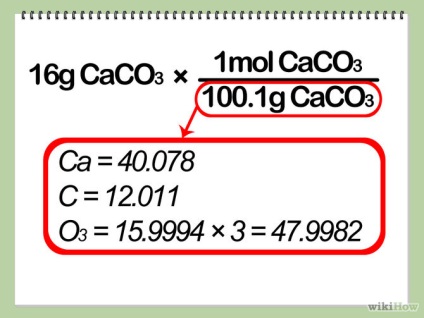
- Щоб розрахувати молярну масу благаючи, складіть атомні маси всіх атомів. Атомна маса атома - це десяткове число, написане під хімічним знаком кожного елемента в періодичній таблиці. Пам'ятайте, що будь-які індексовані числа в молекулі означають, що ці атоми зустрічаються більше одного разу.
- 4 Якщо у вас два реагенту, то порівняйте співвідношення молей ваших реагентів з співвідношенням їх коефіцієнтів. Відповідно, ці співвідношення називаються «фактичним співвідношенням» і «стехиометрическим співвідношенням».

- Якщо фактичне співвідношення більше стехіометричного, то це означає, що реагент знаходиться «в надлишку», значить, інший реагент є обмежуючим.
- Якщо фактичне співвідношення менше, ніж стехиометрическое, значить саме цей реагент, є обмежуючим.
- 5 Якщо ви використовуєте більше двох реагентів, то вам доведеться порахувати кількість молей продукту кожного реагенту після повного закінчення реакції. Реагент, що виробляє найменшу кількість продукту є обмежуючим реагентом.

- Щоб порахувати скільки молей ви отримаєте після закінчення реакції, вам слід помножити кількість моєї реагенту на співвідношення коефіцієнта продукту і коефіцієнта реагенту.
- Проведіть такі підрахунки для кожної реагенту.
Частина 2 з 3: Розрахунок теоретичного виходу продукту
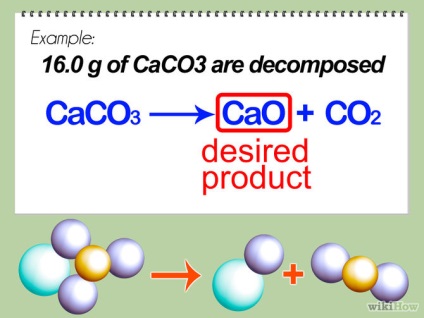
- 1 Визначте бажаний продукт. Він, найчастіше, записується праворуч, щодо стрілки в хімічному рівнянні. У цьому прикладі, CaO буде нашим бажаним продуктом (CO2 - це газ і він розчиниться в повітрі). Ми порахуємо теоретичний вихід - розрахунок того, яка кількість продукту ми сподіваємося отримати в умовах максимально ефективної реакції.
- «Наприклад»: Клер створює 0.45гр нітрату амонію. Вона очікує отримати теоретичний вихід продукту масою в 0.50гр. Який її відсоток виходу?
- 0.45 / 0.50 = 0.9. Помножте цей результат на 100, щоб вирахувати відсоток.
- Відсоток виходу дорівнює 90%. Запишіть масу кожного вашого початкового матеріалу.
- 2 Переведіть масу обмежує реагенту в кількість молей. Ви можете зробити це, розділивши масу реагенту на його молярну масу, як в першій частині кроку 3.
- 3 Визначте експериментальне співвідношення. Розділіть кількість молей вашого бажаного продукту на кількість молей вашого обмежує реагенту. Це число називається експериментальним співвідношенням.
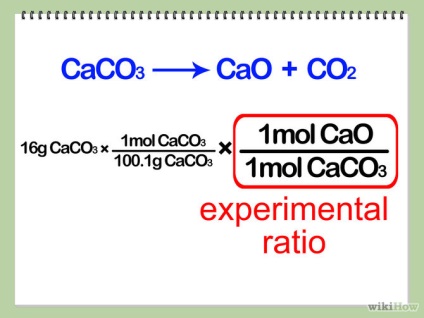
- 4 Обчисліть молярну масу одного моля вашого продукту. Впишіть це співвідношення в ваше зростаюче рівняння, як показано нижче.
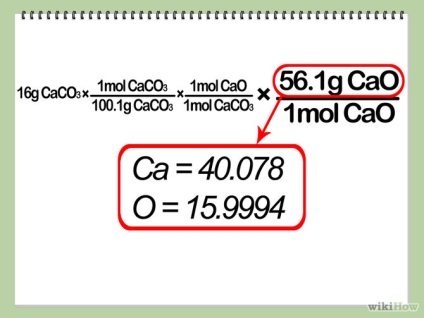
- 5 передбачу теоретичний вихід. Помножте кількість молей обмежує реагенту на співвідношення коефіцієнта продукту до коефіцієнта обмежує реагенту, а після помножте на співвідношення молярної маси продукту. Це дасть вам кількість продукту, яке ви отримаєте, у разі, якщо ваша реакція максимально ефективна (іншими словами, «теоретичний вихід» реакції).
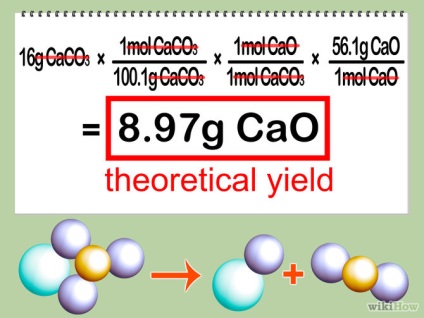
Частина 3 з 3: Розрахунок відсотка виходу
- 1 Проведіть реакцію. Візьміть вийшов чистий продукт від вашої реакції і обчисліть його збалансовану масу. Розрахуйте цю масу.
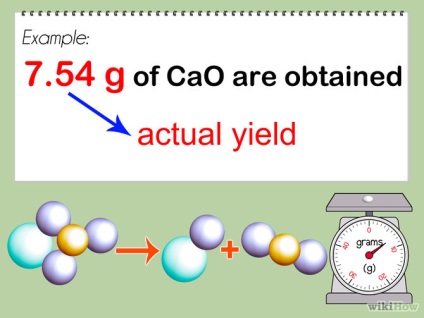
- 2 Перерахуйте масу свого продукту в молях, розділивши його масу на молекулярну масу. Це робиться також, як описано в кроці два, частини 2 вище. Запишіть кількість молей, отримане в ході експерименту як фактичний вихід.

- 3 Порахуйте відсоток виходу. Розділіть фактичний вихід на теоретичний вихід, а потім помножте отриманий результат на сто. У відповіді ви отримаєте відсоток, який покаже масу вашого продукту, в порівнянні з масою продукту «ідеальної» реакції.

попередження
- Існує ймовірність, що ви ви вважаєте відсоток виходу, який становить більше, ніж 100%, не зробивши математичної помилки. Якщо ваш фінальний продукт не чистий (забруднене субстанціями, які не враховувалися в первісному хімічному рівнянні), то ці забруднювачі можуть дати вихід, який більше теоретичного виходу.
- Через це, дуже важливо акуратно очищати продукти, за допомогою фільтрації, просушування, дистиляції, а також будь-яких інших очисних процесів, які будуть різнитися залежно від фізичних властивостей ваших продуктів.