КАТАЛОЗІ (від грец. Katalysis - руйнування), зміна швидкості хім. р-ції при впливі в-в (каталізаторів), к-які беруть участь в р-ції, але не входять до складу продуктів. Каталізатор не знаходиться в стехіометріч. відносинах з продуктами і регенерується після кожного циклу перетворюється. реагентів в продукти. Розрізняють позитивний і негативний К. залежно від того, прискорює каталізатор р-цію або уповільнює її. Як правило, термін "К." відносять до прискорення р-ції; в-ва, що уповільнюють р-цію, наз. інгібіторами. Каталитич. дію на р-цію можуть надавати утворюються в ході р-ції промежут. в-ва або продукти (див. Автокаталіз) .Для К. характерно, що невеликі кількості каталізатора прискорюють превращ. великих кол-в реагуючих в-в. Так, 1 мас. ч. Pt-каталізатора викликає превращ. 10 4 мас. ч. SO3 в SO2 або 10 6 мас. ч. NH3 в NO. Прискорює дію р-розчинника на р-цію в розчинах зазвичай не відносять до К. на тій підставі, що кількість р-розчинника, як правило, значно перевищує кількість розчинених реагують по-в. Відомі, однак, випадки прискорення р-ций у присутності. дуже малих добавок р-розчинника, напр. води. Незмінність хім. складу і структури каталізатора після закінчення процесу навряд чи може служити обов'язковою ознакою К. Відомо, що хім. склад розвантаженого з реактора каталізатора суттєво іншою, ніж у завантаженого; на склад і структуру каталізатора впливає склад реакц. суміші. Незмінність хім. складу і структури каталізатора має сенс розглядати по відношенню до тієї з елементарних стадій складної каталитич. р-ції, в якій безпосередньо бере участь каталізатор, однак для цього необхідно надійно встановити механізм р-ції, що не завжди можливо. Термін "К." введений І. Берцелиусом в 1835. При гомогенному каталізі каталізатор і реагують в-ва знаходяться в одній фазі в молекулярно-дисперсному стані. При гетерогенному каталізі каталізатор утворює самостійно. фазу, відокремлену межею поділу від фази, в якій знаходяться реагують в-ва. Виділяють також гетерогенно-гомогенний К. при к-ром р-ція починається на пов-сті твердого каталізатора, а потім продовжується в обсязі. Міжфазним катализом прийнято називати К. на кордоні двох змішуються рідин; при цьому роль каталізатора полягає в перенесенні реагентів між фазами. Проміжний час. становище між гомогенним і гетерогенним К. займає мікрогетерогенний К. колоїдними частинками в рідкій фазі. Прискорення р-ций у присутності. мицелл ПАР зв. мицеллярная катализом. Виняткову роль в процесах в живих організмах грає ферментативний каталіз, обумовлений дією ферментів. Важливим компонентом пром. каталізаторів є промотори - в-ва, додавання яких брало до каталізатора в малих кол-вах (відсотки або частки відсотка) збільшує його активність. селективність або стійкість. Якщо промотор додається до каталізатора у великих кол-вах або сам по собі каталітично активний, каталізатор зв. змішаним. По-ва, вплив яких на каталізатор призводить до зниження його активності або повного припинення каталитич. дії, зв. отрутами каталітичними. Зустрічаються випадки, коли одна і та ж добавка до каталізатора при одних концентраціях і т-рах є промотором, при інших - отрутою. У гетерог. К. широко застосовують носії - в-ва, самі по собі каталітично неактивні або малоактивні. Нанесення на них каталізатора значно підвищує його активність. гл. обр. внаслідок збільшення пов-сті каталізатора або запобігання його частинок від спікання (див. Завдані каталізатори).
Загальні закономірності каталізу. Все каталитич. р-ції мимовільний процеси, т. е. протікають в напрямку убутку енергії Гіббса системи. Каталізатор не зміщує положення рівноваги хім. р-ції, якщо не брати до уваги його впливу на коеф. активності реагують по-в в розчинах (або коеф. летючості, в разі р-ций в газовій фазі при високому тиску). Поблизу від рівноваги один і той же каталізатор прискорює пряму і зворотну р-ції в рівній мірі, далеко від рівноваги цього може і не бути. З дек. можливих р-ций каталізатор прискорює не обов'язково термодинамічно наиб. вигідну, т. е. ту, для якої спад енергії Гіббса максимальна. Напр. у присутності. Bi2 O3 .MoO3 пропілен окислюється частково (до акролеїну), у присутності. З 3 О 4 відбувається повне окислення (до СО 2 і Н 2 О). Мірою селективності (вибірковості дії) каталізатора є відношення швидкості 1/2 O2. МО, 2) МО + Н 2. М + Н 2 О. одностадійна процеси К. (їх наз. Також асоціативними або злитими) протікають за схемою: А + К. АК *. В + К. В цьому випадку (крива 2 на рис.) Каталізатор не утворює стійких промежут. соед. з реагентами, але входить в активир. комплекс АК *. Р-ція відбувається з подоланням одного потенційного бар'єру, що розділяє початковий і кінцевий стани системи, як і некаталітіч. р-ція, але зі зниженим значенням енергії активації (E4 на рис.). Велика швидкість каталитич. р-ції м. б. обумовлена не тільки зниженням енергії активації внаслідок протікання р-ції за новим механізмом, а й здійсненням під дією каталізатора ланцюгового механізму р-ції. Напр. каталитич. дію парів води на газофазне окислення СО пояснюється утворенням реакц. ланцюгів за участю активних частинок Н і ОН. У гетерогенно-гомог. К. на пов-сті утворюються активні частинки (напр. Своб. Радикали АЛЕ 2 і RO2 при окисленні вуглеводнів RH), к-які потім вилітають в газову фазу і продовжують там ланцюг.
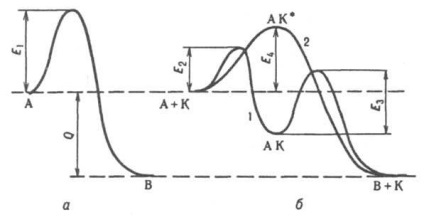
Енергетична діаграма реакції типу А. У; а - без каталізатора, б - з каталізатором К; 1 - при сталійним механізмі, 2 - при асоціативному механізмі каталізу: E1. E2, E4. E4 потенційні бар'єри, що розділяють вихідне і кінцеве стану системи, Q - тепловий ефект р-ції.
Доведено освіту ланцюгів на пов-сті каталізатора при полімеризації олефінів і синтезі вуглеводнів із СО і Н 2. Для мн. інших гетерогенно-каталитич. р-ций виявлені особливості, характерні для ланцюгових р-ций: генерування активних центрів (чергування заповнення місць на пов-сті і їх звільнення), утворення активних промежут. частинок в сверхравновесних концентраціях (що сприяє подоланню бар'єру енергетично невигідних стадій), досягнення макс. швидкості р-ції через недо-рої час після її початку. Каталитич. і ланцюгові р-ції зближує також явище кинетич. сполучення. Якщо превращ. каталізатора при взаємодій. з реагентами пов'язані з самою каталитич. р-цією (т. е. мають загальне промежут. в-во чи активир. комплекс), стає можливим утворення сверхравновесних концентрацій активних центрів на пов-сті каталізатора і ін. ефекти, типові для ланцюгових процесів.
Основні механізми каталізу. Каталитич. процеси, зумовлені перенесенням електрона (окислення, відновлення. гідрування, дегідрування. розкладання нестійких кисневмісних сполук), відносять до окисно-відновного каталізу. Типовими каталізаторами для них є перехідні метали і їх сполуки. прості оксиди (V2 O5. MnO2. МГО 3. Сr2 О 3), шпінелі (Fe3 O4. CuCr2 O4), сульфіди (MoS2. WS2) і ін .; для р-ций в розчинах - солі та комплексні сполуки. перехідних металів. Висока каталитич. активність цих в-в пояснюється тим, що атоми перехідних металів можуть існувати в разл. ступенях окислення, зміна яких брало не вимагає великих енергетичних. витрат. В результаті перенесення електрона від реагенту до каталізатора здійснюється легше, ніж під час відсутності каталізатора від відновника до окислювача. При одноелектронному переході утворюються своб. радикали, далі беруть участь в р-ції. Напр. при переході одного електрона від активного центру молібденового каталізатора до кисню утворюється іон-радикал Про 2. бере участь далі в каталитич. окисленні (Мо 5+ + Про 2. Мо 6 + + О 2; О 2 + С n Н m. продукт). Існує окісліт.-відновить. К. з багатоелектронних механізмом, при к-ром не утворюються своб. радикали в якості промежут. частинок. Багатоелектронні переходи між каталізатором і реагують молекулами можливі, якщо в активний центр каталізатора входять дек. атомів перехідного металу. Напр. в розкладанні Н 2 О 2 активні комплексні сполуки. містять 2 іона Fe 3+; у відновленні мовляв. азоту до N2 H4 - комплексні сполуки. містять 2 або більше іонів V 2+. До процесів кислотно-основного каталізу ставляться каталитич. крекінг. гідратація, дегідратація. мн. р-ції ізомеризації, конденсації орг. в-в. Типові каталізатори для цього класу процесів - в-ва, здатні передавати або приймати протон від реагентів або ж здатні до гетеролітіч. взаємодій. з реагентами (без поділу пари електронів). Серед цих в-в - протонні (H2 SO4. CH3 COOH, HF) і апротонних (BF3. AlCl3) к-ти, аморфні і кристалічні. алюмосилікати. Аl2 Про 3. фосфати, сульфати. Активними центрами в них є протонний центр Н + (центр Бренстеда) або акцептор електронної пари, напр. атом Аl (центр Льюїса). Рідше застосовуються каталізатори основного характеру (розчинені підстави, тверді CaO, MgO і ін.). У разі т. Зв. поліфункціональних каталізаторів окремі етапи складних каталитич. процесів окісліт.-відновлювальні та кислотно-основні - протікають на різних складових частинах багатокомпонентної багатофазної системи. Напр. при неповному окисленні ненасичених альдегідів в ненасичені к-ти в присутності. оксидів Мо і V в елементарному акті відбуваються окісліт.-відновить. перетворення каталізатора:
Хімічна енциклопедія. - М. Радянська енциклопедія. Під ред. І. Л. Кнунянц. 1988.