КІНЕТИКА електродних процесів
В умовах електролізу при проходженні струму через електрод змінюється величина електродного потенціалу в порівнянні з його рівноважним значенням. Ця зміна електродного потенціалу називається поляризацією електрода або перенапруженням електродної реакції. Поляризація викликана протіканням електрохімічного процесу, і тому завжди є зв'язок між швидкістю процесссов, а значить, щільністю струму на електроді, і поляризацією. Завдання електрохімічної кінетики полягає у встановленні характеру зв'язку з цим, щоб свідомо керувати перебігом електрохімічного процесу.
Електрохімічний процес складається з декількох послідовних стадій: транспорту речовини до поверхні електрода, електрохімічної реакції відновлення або окислення на електроді і відведення продуктів реакції. У деяких випадках істотну роль відіграють хімічні реакції: гомогенна, що протікає в електроліті поблизу поверхні електрода, і гетерогенна - на поверхні електрода. У першому випадку в електрохімічну реакцію вступає не те речовина, яке транспортується до електрода, а продукти його розпаду або взаємодії з іншими речовинами, що містяться в електроліті. Така реакція передує електрохімічної стадії. У другому випадку в результаті електрохімічного розряду виходить не кінцеве речовина, а деяке проміжне, адсорбована електродом. Потім відбувається гетерогенна реакція переходу цієї речовини в кінцевий продукт. Іноді доводиться враховувати швидкості утворення нової фази, що з'являється в результаті електрохімічної реакції - кристалів твердої речовини. крапель металу і бульбашок газу.
Залежно від того, яка з цих стадій є лімітуючої, т. Е. Найповільнішої, розрізняють наступні види поляризації, або перенапруження (по Феттер).
Перенапруження переходу викликано замедленностью стадії розряду - іонізації. Зв'язок між перенапруженням і щільністю струму описується рівнянням Тафеля:
де С - щільність струму, А / см 2; а й b - постійні. Для анодного процесу
де k1, константа швидкості електрохімічного процесу, 1 / с; α - коефіцієнт перенесення (кінетичний коефіцієнт), частки. од.
При електрохімічному процесі потенційна енергія іона в електроліті і кінцевого продукту на електроді різна. У енергію активації електродної реакції входить не вся різниця цих енергій, а тільки частина її. Коефіцієнт перенесення й являє собою відношення цієї частини енергії до повної енергії.
Для катодного процесу, в якому грає роль концентрація (активність) потенціал-визначальних іонів, константи рівняння Тафеля матимуть значення:
де С - концентрація іонів, моль / см 3; β - коефіцієнт перенесення для катодного процесу, частки од.
Сума коефіцієнтів переносу а й У дорівнює одиниці і зазвичай приймається, що α = β = 0,5.
Будь-електрохімічний (і хімічний) процес йде як в прямому, так і в зворотному напрямках. Чим далі процес від рівноважного, тим більше прямої процес переважає над зворотним, і навпаки. При рівновазі швидкості прямого і зворотного процесів рівні. Струм обміну і являє собою швидкість електрохімічного процесу в прямому і зворотному напрямках при рівноважному потенціалі. Як випливає зі співвідношення. зі збільшенням струму обміну перенапруження переходу зменшується. Якщо i0 »i. то перенапруження близько до нуля, і процес можна розглядати як рівноважний (оборотний).
Зазвичай струми обміну в розплавлених солях великі-від одиниць до сотень ампер на квадратний сантиметр, що пов'язано з прискоренням процесів при високих температурах.
перенапруження дифузії
Виникає внаслідок сповільненості перенесення реагуючих речовин. Це перенесення може здійснюватися молекулярної дифузією, міграцією (переносом під дією електричного поля заряджених частинок - катіонів та аніонів) і конвекцією (переносом потоком рідини). Зазвичай конвекція викликана виділяються на аноді газами. Ефект міграційного переносу вдається в значній мірі знизити за рахунок створення фону, при якому перенесення електрики здійснюється іншими, неразряжающіміся іонами. Саме таке перенесення має місце в алюмінієвих електролізерах.
Основним лімітуючим процесом зазвичай є молекулярна дифузія як самий повільний процес. Якщо дифузія відбувається до плоского електрода, то дифузійний, ток (для катодного процесу) можна підрахувати з виразу першого закону Фіка:
де С0 - концентрація іонів в глибині електроліту; C8 концентрація іонів на поверхні електрода; -δ - товщина дифузійного шару; D - коефіцієнт дифузії.
Товщина дифузійного шару залежить від умов перемішування електроліту - чим вище швидкість потоків, що обтікають електрод, тим менше б. При електролізі розплавлених солей товщина, дифузійного шару зазвичай становить від 0,1 до 1 мм.
Для рідких електродів в розплавлених солях було відзначено (Поляков з співр.), Що товщина дифузійного шару зменшується за рахунок ефекту Марангони: міжфазне натяг на межі метал - електроліт має різне значення на різних ділянках поверхні електрода, що викликає рух рідини від ділянок з меншим міжфазним натягом до ділянок з великим міжфазним натягненням. Це додаткове перемішування може зменшити δ на порядок.
При падінні концентрації С, до нуля виходить максимальний струм дифузії - так званий граничний дифузійний струм: id = nFDC0 / δ.
Зв'язок між перенапруженням і дифузійним струмом дається виразом:
з якого випливає, що в області граничного струму відбувається різкий зсув потенціалу в негативну сторону і на поляризационной кривої відзначається майданчик граничного струму. Потенціал електрода при цьому зсувається настільки, що починається розряд іншого, більш електронегативного катіона (наприклад, катіона фону). Якщо будувати поляризаційну криву до граничного струму, то в координатах ηd -1n (1-i / id) виходить пряма, нахил якої дозволяє визначити п - число електронів, що беруть участь в електрохімічної реакції.
Якщо перенапруження визначається замедленностью дифузії аніонів в процесі анодного розряду, то відповідне рівняння зв'язку між струмом дифузії і перенапруженням буде
де id - граничний струм дифузії аніонів, А / см 2.
перенапруження реакції
Викликано уповільненням хімічних реакцій на стадіях до або після розряду - іонізації. Розглянемо гетерогенную реакцію, наступну після розряду, як найбільш важливу для подальшого викладу.
Припустимо, що електрохімічний процес складається з двох послідовних стадій: окислення речовини R: R- ne ⇄ ОС утворенням проміжного окисленого речовини О, що адсорбується на поверхні електрода, і гетерогенної реакції O ⇄ A. при якій утворюється кінцевий продукт А. Припустимо, що стадія розряду протікає швидко, практично равновесно, в той час як подальша гетерогенна реакція - повільно. Швидкість цієї повільної стадії складається з швидкості прямого процесу, пропорційної поверхневої концентрації речовини Про певною мірою р (порядок реакції), і швидкості зворотного процесу υ = υ - υ = kC0 p - υ, де k - константа швидкості реакції, см / с.
При рівновазі швидкості цих процесів рівні: υ0 = υ = υ = kC0 p при цьому С0 - поверхнева концентрація речовини в рівновазі, моль / см 2. Якщо в процесі є великий надлишок речовини А і його концентрація не залежить від потенціалу, то незалежної буде і C0 Перенапруження реакції визначається виразом:
де С0 поверхневі концентрація речовини Про при поляризації. Швидкість процесу, або щільність струму
Ho nF υ0 = i0 - щільність струму при рівновазі (струм обміну), тому
З виразів (34) і (35) випливає зв'язок між щільністю струму і перенапруженням:
Якщо i / io »1, то вийде рівняння Тафеля:
У координатах ηр - ln i ця залежність виражається прямою лінією, як і в разі перенапруги переходу, але замість коефіцієнта перенесення тут фігурує порядок гетерогенної хімічної реакції р, і коефіцієнт b в рівнянні Тафеля буде істотно меншим.
2. Механізм катодного процесу
Катодний процес включає в себе наступні послідовно йдуть стадії: транспорт оксіфторідних і фторідних комплексів, що містять іони алюмінію, з глибини розплаву до катода; розпад комплексів в подвійному шарі з утворенням вільних іонів Аl 3+. і розряд іонів Аl 3+. Не виключено, що розряд відбувається безпосередньо з комплексних іонів, минаючи стадію їх розпаду. При відновленні алюмінію з кріоліту-глиноземних розплавів на индифферентном катоді (наприклад, вольфрамовому) виявляються на поляризаційних кривих два майданчики (Антипин), що відповідають двом процесам: Аl 3 + 2е = Аl +, Аl + + е = Аl. Якщо катод - рідкий алюміній. процесу перезарядження немає, оскільки в присутності алюмінію швидко встановлюється рівновага між іонами Al 3+. Аl + і металом.
Імпедансні вимірювання, т. Е. Дослідження комплексного опору електродної системи алюміній - кріоліту-глиноземний розплав в колі змінного струму
в залежності від частоти, дозволили оцінити величину струму обміну для цієї системи. Виявилося, що струм обміну при температурі електролізу становить близько 20 А / / см 2. т. Е. Алюмінієвий електрод є практично оборотним і перенапруження переходу становить всього кілька мілівольт. Ці вимірювання вказали на дифузний характер перенапруги.
Дослідження поляризації алюмінієвого електрода в лабораторній осередку (Борисоглібський і ін.) В умовах, коли анодний процес зводився до розчинення алюмінію (т. Е. Анодних газів не виділялося) і перемішування аноліта і католіта було мінімальним, показало, що на поляризаційних кривих є майданчики граничного струму (рис. 17, крива /).
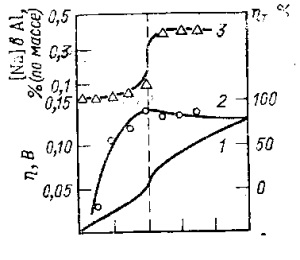
З ростом щільності струму в прікатодном шарі зменшується концентрація комплексних оксіфторідних і фторідних іонів, що містять катіони Аl 3+. і збільшується концентрація іонів Na +. Оскільки електрод оборотний (перенапруження переходу відсутній), зростання концентрації іонів Na + призводить до підвищення вмісту натрію в алюмінії і зрушенню потенціалу в негативну сторону. Отже, відбувається спільний розряд іонів алюмінію і натрію, тільки натрій не виділяється у вигляді окремої фази (бульбашки при атмосферному тиску), а розчиняється в алюмінії і в сольовому розплаві.
Таким чином, при -всіх умовах електролізу має місце спільний розряд алюмінію і натрію, причому останній зазвичай виділяється у вигляді розчину в алюмінії. Оскільки обидва метали виділяються на одному електроді, їх потенціали повинні бути однакові:
При поляризації католіт збагачується фторидом натрію і збіднюється фторидом алюмінію в порівнянні з рівноважним складом. Тому величина поляризації катода дорівнює е. д. з. концентраційної ланцюга:
Тут в першому напівелементах представлені склад електроліту і сплаву алюміній - натрій для рівноважного електрода, у другому - для поляризованого,
Е. д. С. ланцюга дорівнює
Дифузійний потенціал на межі поділу напівелементів:
оскільки струм переноситься тільки іонами натрію. Тому
Використовуючи вираз для константи рівноваги реакції
Електроліт і метал в промислових ваннах знаходяться в безперервному русі, при цьому на поверхні металу утворюються хвилі. Рух електроліту і металу сприяє зняттю перенапруги дифузії, і алюмінієвий електрод є практично рівноважним.
Виділення натрію на алюмінії визначається в основному кріолітовий ставленням і температурою: чим вони вищі, тим більше виділяється натрію. Натрій йде з алюмінію двома шляхами: 1) розчиняється в електроліті, переноситься до анода і окислюється; 2) проходить через товщу алюмінію і поглинається вугільної футеровкою. Перший шлях приводить до значних втрат струму і до зниження виходу за струмом, другий - до передчасного руйнування вугільної футеровки електролізерів.