CTLA-4: як змусити імунітет вбивати ракові клітини
В першу групу кандидатів, яку назвало Thomson Reuters, увійшли Джеймс Еллісон, Джеффрі Блюстоун і Крейг Томпсон. Джеймс Елісон присвятив боротьбі з раком все життя. Дослідження, в яких він брав участь, зробили революцію лікуванні раку. Він став одним з піонерів використання природного імунітету в боротьбі з раковими клітинами.
Більшу частину життя клітини імунної системи, лімфоцити, проводять в розвідці. Частина з них веде життя резидентів у внутрішніх органах, інша частина постійно переміщається по кровоносній системі. Щоб перетворитися з розвідників в воїнів або навпаки, Т-лімфоцитам потрібен хімічний сигнал. Частково Т-лімфоцити активуються при зустрічі з потенційним противником, але на початку дев'яностих вченим стало ясно, що важливі й інші механізми стимуляції. Додаткові сигнали лімфоцитам подають мембранні білки-рецептори. Одні змушують лімфоцит боротися з антитілами, а інші, навпаки, деактивує або навіть знищують його. На сьогоднішній день відомо три головних білка-деактиватора лімфоцитів: PD-1, CTLA-4 і TIM-3. Білки, які виводять лейкоцити з ладу, не менш важливі, ніж білки-активатори: без них імунна система організму вбиває навіть здорові клітини. Їх вивчення - це головний фронт сучасної імунології в онкології.

Еллісон створив ліки від раку, вивчивши мембранний білок лимфоцита CD28, який запускає режим «воїна», і білок CTLA-4, який деактивує лімфоцит, не даючи йому знищувати клітини.
Великий внесок у вивчення функцій CD28 і CTLA-4 внесли Джеффрі Блюстоун і Крейг Томпсон: саме вони довели, що ці білки працюють в парі, то активуючи, то деактивувавши лімфоцит (до його досліджень вважалося, що ці білки відповідають за розподіл лімфоцитів). Відкриття Блюстоуна і Томпсона здивувало колег: ніхто не очікував, що два гомологічних протеїну поводитимуться так відмінно один від одного.
Ідея Еллісона полягала в тому, щоб «вимкнути вимикач» - деактивувати CTLA-4, щоб дати лімфоцитам шанс побороти ракову пухлину. Припущення Еллісона з великим скепсисом взяли в науковому співтоваристві, але клінічні дослідження дали вражаючі результати: через 4 місяці з групи хворих, яких лікували інгібіторами CTLA-4, вижило більше 20% пацієнтів. У контрольній групі не вижив ніхто. Ліки, розроблені на основі досліджень Еллісона, Блюстоуна і Томпсона, врятували життя тисячам людей.
PD-1: як не дати імунній системі відпочити
Друга група вчених-біологів, яких Thompson Reuters пророкує в нобелівські лауреати, теж займалася іммуннотерапіей раку, проте вже за допомогою PD-1 - рецептора, що запускає процес программіруемоц смерті клітини.
Все почалося в вісімдесятих, коли японський біолог Тасуку Хондзе. Його роботи так само присвячені вивченню роботи білка PD-1. У вісімдесяті Хондзе встановив гени, що відповідають за синтез PD-1, і визначив його роль в організмі: виявилося, цей білок відповідає за апоптоз - процес самознищення клітин.
Гарвардський біолог Гордон Фрімен (тезка і колега відомого доктора з Half Life) займався тими ж білками-рецепторами Т-лімфоцитів - CTLA-4 і CD28, а також механізмами програмної смерті клітин і PD-1. В експериментах Фрімена миші, лімфоцити яких виробляли дуже мало PD-1, гинули в ранньому дитинстві від безлічі аутоімунних захворювань. За відсутності цього важливого білка, який, як і CTLA-4, деактивує лімфоцити, їх імунітет вбивав все їх органи і тканини.
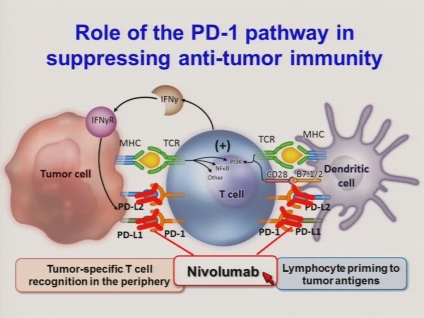
Фримену вдалося описати механізм його роботи. Зв'язуючись з відповідним лігандом PD-L1 на поверхні лімфоцита PD, як і CTLA-4, деактивує лімфоцит. Крім того, PD-1 запускає процес апоптозу - запрограмованої смерті клітини. Здоровому організму іноді потрібно вбивати власні лімфоцити - наприклад, при вагітності, щоб тіло не прийняло плід за чужорідне тіло, яке потрібно знищити. Механізм також запускається при аутоімунних захворюваннях, коли організм, щоб вижити, повинен вбити не в міру активну імунну систему.
Гордон Фрімен і Арлін Шарп встановили, що ракові клітини вміють використовувати PD-L1 / PD-1 комплекс в своїх цілях, обманом примушуючи організм вимкнути імунну систему. Майже 15 років пішло на розробку ліків на основі антитіл, які зв'язуються з PD-1 і не дають йому виконувати свою функцію. Клінічні випробування виявилися особливо успішними для пацієнтів з меланомою: довгострокова ремісія спостерігалася у неймовірних для онкологічних досліджень 40% хворих. Для інших видів раку ліки виявилися трохи менше, але все ж ефективні. Багато в чому прогрес в розробці препаратів-інгібіторів PD-1 пов'язаний з щедрим рішенням Фрімена і Шарп відкрити свої розробки та патенти для всього наукового співтовариства. Це втягнуло безліч лабораторій по всьому світу в роз подібних ліків.
mTOR: як зупинити неконтрольоване ділення клітин
Все почалося з того, що в зразку грунту, привезеному з острова Пасхи, виявилася бактерія, яка виробляла сильний фунгіцид. Речовина назвали рапаміцином. Коли його спробували застосувати для лікування грибкових захворювань у людей, виявилося, що рапаміцин здатний пригнічувати імунну систему, регулюючи життєвий цикл Т-лімфоцитів. Його стали активно використовувати для попередження аутоімунною реакції і відторгнення органів після пересадки.
На початку 90-х вдалося зрозуміти, як працює рапаміцин. Генетичне дослідження виявило, що для того, щоб рапаміцин перестав працювати, потрібно змусити «замовчати» три гена. Продукти транскрипції цих генів назвали «мішенню рапаміціна» (Target of rapamycin, TOR). Через три роки дослідження на дріжджах було закінчено, і вчені звернулися до пошуку мішені рапаміцину у ссавців. Їй виявився білок mTOR.
Робота mTOR полягає в фосфорилировании білків під час того, як вони синтезуються на «клітинному конвеєрі» - рибосоми. Додаючи фосфатну групу атомів до окремих амінокислот ( «будівельним блокам» білків), mTOR здатний визначити подальшу долю білка, його активність або неактивність в клітці. Велика частина білків, з якими працює mTOR відповідають за процеси росту і поділу клітин, а також за процеси клітинного обміну. Якщо mTOR зробить їх надто активними, клітини почнуть безконтрольне розподіл - перетворяться в ракову пухлину. Зараз вчені працюють над препаратами - інгібіторами mTOR. Останні розробки в цій галузі спрямовані на те, щоб не дати білку отримати від молекули АТФ фосфатну групу і тим самим позбавити його можливості виконувати своє основне завдання.