1.Атом - складна частка. Стан електронів Ватомо.
1.1Атом - складна частка.
Атом - електронейтральна система взаємодіючих елементарних частинок, що складається з ядра (утвореного протонами і нейтронами) і електронів.
Електрони, протони і нейтрони називають елементарними частинками. Які ж властивості цих часток?
Корпускулярно-хвильові властивості мікросвіту. Елементарні частинки, а також побудовані з них атомні ядра, атоми і молекули мають мізерно малі маси і розміри і тому володіють своїми особливими властивостями несхожими на ті, які мають об'єкти оточуючого нас макросвіту. Вони утворюють свій, специфічний світ - мікросвіт. який живе за особливими законами, які диктуються квантовою механікою - наукою про будову і властивості елементарних частинок, ядер, атомів і молекул.
Квантова механіка характеризує частки мікросвіту як об'єкти з подвійною природою - корпускулярно-хвильовим дуалізмом. вони є одночасно і частками (корпускулами), і хвилями.
Електрон - частинка, яка визначає найбільш характерні хімічні властивості атомів і молекул. Подвійна природа електрона може бути підтверджена на досвіді. Якщо електрони, що випускаються джерелом, наприклад катодом, пропускати через маленькі отвори в пластинці, поставленої на їхньому шляху, то вони, потрапляючи на фотопластинку, викликають її почорніння. Після прояви фотопластинки на ній можна побачити сукупність чергуються світлих і темних кілець, тобто дифракційну картину (рис.1).
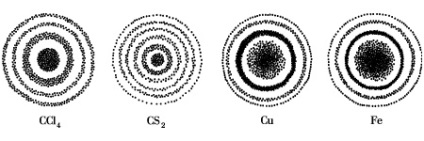
Електронограмми газів (зліва) і кристалів (праворуч).
Центральне пляма обумовлено нерозсіяних пучком електронів,
а кільця - електронами, розсіяними під різними кутам
Дифракційна картина включає в себе як власне дифракцию - огибание хвилею перешкоди, так і інтерференцію. тобто накладення хвиль один на одного. Ці явища доводять наявність у електрона хвильових властивостей, так як тільки хвилі здатні огинати перешкоди і накладатися одна на одну в місцях їх зустрічі. Однак, потрапляючи на фотослой, електрон дає почорніння лише в одному місці, що свідчить про наявність у нього корпускулярних властивостей. Будь він тільки вільний, він більш-менш рівномірно засвечивал б всю платівку.
1.2Состояніе електронів в атомі
Електрон в атомі не має траєкторії руху, тобто можна говорити лише про ймовірність знаходження його в просторі навколо ядра. Він може знаходитися в будь-якій частині цього простору, що оточує ядро, і сукупність різних положень його розглядають як електронне хмара з певною щільністю негативного заряду.
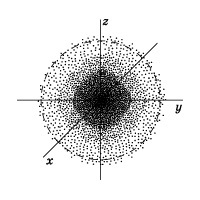
На малюнку 2.показан «розріз» такої електронної щільності в атомі водню, що проходить через ядро, а штриховий лінією обмежена сфера, всередині неї ймовірність виявлення електрона складає 90%. Найближчий до ядру контур охоплює область простору, в якій ймовірність виявлення електрона
10%, ймовірність ж виявлення електрона всередині другого від ядра контуру складає
20%, усередині третього -
Область ймовірності виявлення електрона не має чітких меж. Однак можна виділити простір, де ймовірність знаходження електрона буде максимальною.
Простір навколо атомного ядра, в якому найбільш найімовірніше перебування електрона, називається орбиталью.
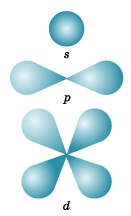
У ньому укладено приблизно 90% електронного хмари, і це означає, що близько 90% часу електрон знаходиться в цій частині простору. За формою розрізняють 4 відомих нині типу орбіталей, які позначають латинськими буквами s. p. d і f. Графічне зображення деяких форм електронних орбіталей представлено на малюнку 3.
Найважливішою характеристикою руху електрона на певній орбіталі є енергія його зв'язку з ядром.
Електрони, що володіють близькими значеннями енергії, утворюють єдиний електронний шар або енергетичний рівень. Енергетичні рівні нумерують, починаючи від ядра: 1, 2, 3, 4, 5, 6 і 7.
Ціле число n. позначає номер енергетичного рівня, називають головним квантовим числом.
Число енергетичних рівнів (електронних шарів) в атомі дорівнює номеру періоду в системі Д. І. Менделєєва, до якого належить хімічний елемент: у атомів елементів першого періоду - один енергетичний рівень, другого періоду - два, сьомого періоду - сім.
Найбільше число електронів на енергетичному рівні визначається за формулою
де N - максимальне число електронів; n - номер рівня або головне квантове число. Отже, на першому, найближчому до ядра енергетичному рівні може перебувати не більше двох електронів;
на другому - не більше 8;
на третьому - не більше 18;
на четвертому - не більше 32.
А як, в свою чергу, влаштовані енергетичні рівні (електронні шари)? Починаючи з другого енергетичного рівня (n = 2), кожен з рівнів підрозділяється на підрівні (підшари), що трохи відрізняються один від одного енергією зв'язку з ядром.
Число підрівнів дорівнює значенню головного квантового числа. перший енергетичний рівень має один підрівень; другий - два; третій - три; четвертий - чотири підрівні. Підрівні, в свою чергу, утворені орбіталямі.Подуровні прийнято позначати латинськими літерами, так само як і форму орбіталей, з яких вони складаються: s. p. d. f.
s-підрівень - перший, найближчий до ядра атома підрівень кожного енергетичного рівня, складається з однієї s орбіталі;
р-підрівень - другий підрівень кожного, крім першого, енергетичного рівня, складається з трьох p орбіталей;
d-підрівень - третій підрівень кожного, починаючи з третього, енергетичного рівня, складається з п'яти d орбіталей;
f-підрівень кожного, починаючи з четвертого, енергетичного рівня, складається з семи f -орбіталей.
2. Електронні конфігурації атомів хімічних елементів
Швейцарський фізик В. Паулі в 1925 р встановив, що в атомі на одній орбіталі може знаходитися не більше двох електронів, що мають протилежні (антипаралельні) спини (в перекладі з англійської "веретено"), Цей принцип носить назву принципу Паулі.
Якщо на орбіталі знаходиться один електрон, то він називається неспареним. якщо два, то це спарені електрони. тобто електрони з протилежними спинами
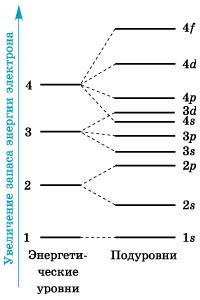
Схема підрозділу енергетичних рівнів на підрівні
На малюнку 1 показана схема підрозділи енергетичних рівнів на підрівні.
s-Орбиталь. як ви вже знаєте, має сферичну форму.
Електрон атома водню (n = 1) розташовується на цій орбіталі і неспарен. Тому його електронна формула або електронна конфігурація буде записуватися так: 1s 1. В електронних формулах номер енергетичного рівня позначається цифрою, що стоїть перед буквою (1.), латинською буквою позначають підрівень (тип орбіталі), а цифра, яка записується справа вгорі від букви ( як показник ступеня), показує число електронів на підрівні.
Для атома гелію He, що має два спарених електрона на одній s орбіталі, ця формула: 1s 2.
Електронна оболонка атома гелію завершена і дуже стійка. Гелій - це інертний газ.
На другому енергетичному рівні (n = 2) є чотири орбіталі: одна s і три p. Електрони s орбіталі другого рівня (2s -opбіталі) мають більш високою енергією, так як знаходяться на більшій відстані від ядра, ніж електрони 1s орбіталі (n = 2)
p-Орбиталь має форму гантелі або об'ємної вісімки. Всі три p орбіталі розташовані в атомі взаємно перпендикулярно вздовж просторових координат, проведених через ядро атома. Слід підкреслити ще раз, що кожен енергетичний рівень (електронний шар), починаючи з n = 2, має три p орбіталі. Зі збільшенням значення n електрони займають p орбіталі, розташовані на великих відстанях від ядра і спрямовані по осях х, у, z.
У елементів другого періоду (n = 2) заповнюється спочатку одна s орбіталь, а потім три p орбіталі. Електронна формула Li. 1s 2 2s 1. Електрон 2s 1 слабкіше пов'язаний з ядром атома, тому атом літію може легко віддавати його (як ви, очевидно, пам'ятаєте, цей процес називається окисленням), перетворюючись в іон Li +.
В атомі берилію Be0 четвертий електрон також розміщується на 2s орбіталі: 1s 2 2s 2. Два зовнішніх електрона атома берилію легко відриваються - Ве0 при цьому окислюється в катіонВе2 +.
У атома бору п'ятий електрон займає 2p орбіталь: 1s 2 2s 2 2p 1. Далі у атомів C. N. О. F йде заповнення 2p -орбіталей, яке закінчується у благородного газу неону: 1s 2 2s 2 2p 6.
У елементів третього періоду заповнюються відповідно 3s - і 3р-орбіталі. П'ять d орбіталей третього рівня при цьому залишаються вільними:
Іноді в схемах, що зображують розподіл електронів в атомах, вказують тільки число електронів на кожному енергетичному рівні, тобто записують скорочені електронні формули атомів хімічних елементів, на відміну від наведених вище повних електронних формул, наприклад: 11Na 2, 8, 1; 17Cl 2, 8, 7; 18Ar 2, 8, 8.
У елементів великих періодів (четвертого і п'ятого) перші два електрона займають відповідно 4s - і 5s орбіталі: 19K 2, 8, 8, 1; 38Sr 2, 8, 18, 8, 2. Починаючи з третього елемента кожного великого періоду, наступні десять електронів надійдуть на попередні 3d - і 4d орбіталі відповідно (у елементів побічних підгруп): 23V 2, 8, 11, 2; 26Fe 2, 8, 14, 2; 40Zr 2, 8, 18, 10, 2; 43Tr 2, 8, 18, 13, 2. Як правило, тоді, коли буде заповнений попередній d -подуровень, почне заповнюватися зовнішній (відповідно 4р- і 5р-) p -подуровень: 33As 2, 8, 18, 5; 52Те 2, 8, 18, 18, 6.
У елементів великих періодів - шостого і незавершеного сьомого - електронні рівні і підрівні заповнюються електронами, як правило, так: перші два електрона надійдуть на зовнішній s -подуровень: 56Ва 2, 8, 18, 18, 8, 2; 87Fr 2, 8, 18, 32, 18, 8, 1; Наступного один електрон (у La і Ac) на попередній d -подуровень: 57La 2, 8, 18, 18, 9, 2 і 89Ас 2,8,18, 32, 18, 9, 2.
Потім наступні 14 електронів надійдуть на третій зовні енергетичний рівень на 4f - і 5f орбіталі відповідно у лантаноїдів і актиноїдів:
Потім знову почне забудовуватися другий зовні енергетичний рівень (d -подуровень): у елементів побічних підгруп: 73Та 2, 8, 18, 32, 11, 2; 104Rf 2, 8, 18, 32, 32, 10, 2, - і, нарешті, тільки після повного заповнення десятьма електронами d -подуровня буде знову заповнюватися зовнішній p -подуровень:
Дуже часто будова електронних оболонок атомів зображують за допомогою енергетичних або квантових осередків - записують так звані графічні електронні формули. Для цього запису використовують такі позначення: кожна квантова комірка позначається кліткою, яка відповідає одній орбіталі; кожен електрон позначається стрілкою, відповідної напрямку спина. При записи графічної електронної формули слід пам'ятати два правила: принцип Паулі. згідно з яким в осередку (орбіталі) може бути не більше двох електронів, але з антипаралельними спинами, і правило Ф. хунди. згідно з яким електрони займають вільні комірки (орбіталі), розташовуються в них спочатку по одному і мають при цьому однакове значення спина, а лише потім спаровуються, але спини при цьому за принципом Паулі будуть вже протилежно спрямованими.
На закінчення ще раз розглянемо відображення електронних конфігурацій атомів елементів першого і другого періодів системи Д. І. Менделєєва.
Елементи першого періоду
Схожі документи:
конспектлекційпо курсу «Хімія поверхні» доц. Василевська Є.І. Лекція 1 Загальні уявлення про поверхні твердих тіл Історія становлення хімії. Фрактальної поверхні відповідає випадок дробової розмірності. ряд вимог. складає близько.
КОНСПЕКТЛЕКЦІЙпо. загальними класами змінити пристрій, згідно з сучасними вимогами педагогії, як по частині виховної, так і по. ; в піротехнічною - хімія. лабораторна справа і пороходелия. заготовлений складаються у відповідних військово.
Конспектлекційпо дисципліни: «Методи дослідження параметрів невпорядкованих напівпровідникових структур» (8 лекцій. Вимогам. Покриттів, хімію полімерів і. В загальному випромінювання. = Відповідає кругової поляризації. І поляризатора і складають (0,5 - 1).
Конспектлекційпо. по електрофізичних параметрів ФС є одними з найважливіших технологічних вимог. см2, що визначається відповідно до формули (8). поверхневої хімією. називаються. загальному випадку товщина реакційної зони становить.