корозія металів
Руйнування матеріалу під дією зовнішнього середовища називають корозією.
Будь-яка конструкція, в тому числі і зварна, піддається дії навколишнього середовища (повітря, вода, виробничі гази, блукаючі струми). Дія середовища може бути агресивним або малоагрессівних. У першому випадку конструкція може служити кілька років або навіть місяців, а в другому-десятиліттями і навіть століттями.
Корозія металів може бути викликана хімічними та електрохімічними процесами. До хімічних відносяться процеси, що протікають при безпосередньому хімічній взаємодії між металом і агресивним середовищем і не супроводжуються виникненням струму. Під електрохімічними розуміють процеси, при яких руйнування металу супроводжується появою електричного струму (процеси в воді, електролітах, вологих газах, розплавлених солях і лугах).
Особливо небезпечна межкристаллитная корозія, характерна появою тріщин. Руйнування відбувається по межах кристалітів, що порушує зв'язок між ними і призводить до несподіваного руйнування, так як дуже часто зовнішній вигляд виробу при межкрісталліт-ної корозії не змінюється.
Корозія - це процес фізико-хімічного руйнування металу під впливом зовнішнього середовища. За характером процесу розрізняють хімічну і електрохімічну корозію. У першому випадку процес окислення металу відбувається при безпосередньому впливі дотичної з ним середовища без появи електричного струму, а в другому випадку корозія протікає в електролітах і супроводжується появою електричного струму. Залежно від характеру агресивного середовища електрохімічна корозія може бути атмосферної, грунтової, структурної (внаслідок неоднорідності металу по структурі), біологічної (протікає в підземних умовах за участю мікроорганізмів), лужної, кислотної, контактної (при контакті двох різнорідних металів), корозією, викликаної блукаючими струмами або водними розчинами солей. Стійкість проти корозії залежить від хімічного складу, структури, стану поверхні, напруженого стану металу, а також хімічного складу, концентрації, температури і швидкості переміщення агресивного середовища по поверхні виробу. Мірою корозійної стійкості є швидкість корозії металу в даних умовах і середовищі, яка виражається глибиною корозії в міліметрах на рік або у втраті маси в грамах за годину на 1 м2 поверхні металу.
Корозія є руйнування металів внаслідок взаємодії їх із зовнішнім (корозійної) середовищем. Цей термін походить від латинського слова корозії - роз'їдання. Корозія - страшний бич промисловості, будівництва, транспорту. Значна частина щорічно виробленого металу йде на те, щоб відновити втрати від корозії.
Метали отримують шляхом виділення їх з природних стійких з'єднань, наприклад оксидів. У процесі корозії метал під дією навколишнього середовища знову прагне перейти в більш стійке з'єднання. Зокрема, при корозії стали часто виникають оксиди і гідроксиди заліза, які мають нещільної структурою і погано пов'язані з основним металом. В кінцевому підсумку зменшується площа перетину виробів, знижується їх міцність. У найбільш важких випадках корозія вражає вироби наскрізь, і вони руйнуються.
Ступінь корозійного ураження металів і сплавів в основному залежить від наступних факторів: хімічного складу і структури металу або сплаву, хімічного складу зовнішнього середовища, температури середовища, напруженого стану металу в конструкції. Корозію класифікують по геометричному характеру руйнувань і за характером взаємодії металу із середовищем.
За геометричному характеру корозійних руйнувань розрізняють суцільну, місцеву, підповерхневому, межкристаллитную, виборчу корозію. При суцільний корозії метал руйнується рівномірно по всій поверхні. Місцева корозія порушує цілісність металу на окремих ділянках поверхні виробу і виражається в ураженні поверхні точками, плямами, виразками. Підповерхнева корозія починається в товщі металу. Продукти такої корозії, збільшуючись в обсязі, виходять на поверхню металу і викликають місцеве руйнування вироби. Межкристаллитная корозія протікає по межах зерен металу і різко погіршує його механічні властивості. Виборча корозія зводиться до розчинення окремих структурних складових сплавів.
За характером взаємодії зо се-д о м корозія буває хімічна і електрохімічна.
Хімічна корозія протікає в середовищах, що не проводять електричного струму, наприклад в сухих газах, рідинах органічного походження-нафти, бензині, спирті і т. П. Найбільш інтенсивно така корозія проявляється при підвищеній температурі. В результаті на поверхні деталей утворюється оксидна плівка. Щільна плівка оберігає внутрішні шари вироби від окислення. Такі плівки виходять, зокрема, при корозії алюмінію і міді. Пухка плівка не захищає метал від подальшого ураження.
Процес окислення посилюється під впливом температури. Так, швидкість корозії вуглецевої сталі в газах з температурою до 600 ° С дуже мала, при більш високій температурі проникність оксидної плівки різко зростає. Це збільшує товщину шару окалини, яка, будучи слабо зчеплені з основним металом, відпадає. Леговані стали допускають без помітного окислення нагрів до більш високих температур.
Електрохімічна корозія протікає у водних розчинах електролітів - солей, кислот, лугів. Це найбільш поширений вид корозії. Будівельні металеві конструкції, здебільшого працюють у вологому повітрі, схильні в основному електрохімічної корозії, яка посилюється зі зростанням концентрації в повітрі вуглекислого і сірчистого газів. Інтенсивно корродируют конструкції, що знаходяться в грунті, наприклад трубопроводи.
При електрохімічної корозії частина атомів з кристалічної решітки металу або сплаву переходить в розчин електроліту у вигляді іонів. У металі залишається еквівалентну кількість електронів. В результаті метал заряджається негативно, а навколишній розчин електроліту - позитивно. Виникає гальванічна пара, в якій частинки руйнується металу поступово переходять в розчин.
Процес електрохімічної корозії залежить оу виду металу. Якщо гальванічна пара складається з двох металів, то розчиняється метал, що стоїть правіше в ряді напруг: золото, срібло, мідь, свинець, олово, нікель, залізо, хром, цинк, марганець, титан, алюміній, магній. Таким чином, при контакті заліза з цинком розчиняється цинк, а заліза з медью- залізо. У парі метал - неметалл в електроліті розчиняється метал.
Гальванічні пари виникають також між дрібними зернами сплавів, якщо вони різняться за хімічним складом і фізичними властивостями. Зокрема, що входять до складу стали феррит і цементит утворюють гальванічну пару, в якій анодом буде феррит, катодом - цементит. Тому в процесі корозії феррит розчиняється (рис. 14).
Електрохімічна корозія стали в лужному середовищі значно сповільнюється. Ця обставина використовують при виготовленні залізобетону. В процесі твердіння більшості цементів виникає лужне середовище, яка сприяє утворенню на поверхні сталевої арматури захисної плівки з нерозчинних сполук заліза типу Fe (OH) 3. Відбувається так зване пассивирование заліза. Плівка оберігає метал від корозії. Тому в залізобетонних конструкціях, що знаходяться в повітряному середовищі з відносною вологістю не більше 60%, корозії арматури немає. Зі збільшенням вологості середовища зростає і ймовірність корозії сталевої арматури. Звідси випливає обов'язкова вимога - захищати її в конструкціях шаром щільного бетону товщиною 15. 40 мм, мало проницаемого для водяної пари. У сильно агресивних середовищах застосовують додаткові заходи захисту сталевої арматури конструкцій.
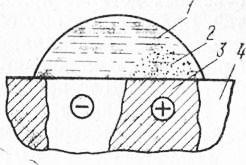
Мал. 14. Схема електрохімічної корозії стали:
1 - вода, 2 - продукти корозії, 3 - ферит, 4 - цементу
Захист від корозії є конструктивні і профілактичні заходи, підвищення корозійної стійкості металів, ізоляцію їх поверхні від впливу середовища, протекторний захист.
Конструктивні та профілактичні заходи полягають у підвищенні якості обробки поверхні металевих виробів, а також в захисті конструкцій від атмосферних опадів. У відповідальних деталях вдаються до полірування поверхонь. Завдяки цьому скорочується реальна площа поверхні металу, що контактує із середовищем. Крім того, з полірованих поверхонь швидше стікає волога. Для профілактики корозії консервують дорогі машини і механізми захисними мастильними матеріалами.
Підвищення корозійної стійкості досягається введенням до складу стали легуючих добавок хрому, нікелю, марганцю, титану, міді. Вельми стійкі до атмосферної корозії нержавіючі леговані сталі, що містять у великій кількості хром, який створює на поверхні виробів щільну оксидну плівку. Ця плівка пасивує сталь. Використовувані в будівництві вуглецеві і низьколеговані сталі іноді виготовляють з добавкою 0,2 ... 0,5% міді, що підвищує корозійну стійкість в 1.5 ... 3 рази.
Ізоляція поверхні металу від впливу середовища - найбільш поширений Спосіб захисту будівельних конструкцій шляхом використання покриттів або отримання на поверхні металу захисної плівки.
Неметалеві покриття утворюють на поверхні виробів захисну плівку, що перешкоджає проникненню вологи. Тим самим запобігає можливість розвитку корозії.
У число неметалічних покриттів входять в основному лаки і фарби. Використовують бітумні, дегтевиє, синтетичні лаки, а також олійні фарби, алкид Цінні та інші емалі. Санітарно-технічні вироби-ванни, раковини, мийки-захищають неорганічними емалями. Для цього на поверхню наносять тонкий шар суміші, що складається з кварцу, польового шпату, глини, бури. У процесі випалу при температурі 750 ... 800 ° С утворюється силікатний розплав, рівномірно покриває поверхню виробу. Отримана емаль відрізняється високою міцністю, твердістю, корозійну стійкість. Нерідко захисні покриття виконують з полімерів - поліетилену, поливи-нілхлоріда, полістиролу, епоксидних смол. Поверхні закладних деталей збірних залізобетонних конструкцій захищають за допомогою цементно-поли бутадієну або цементно-перхлорвінілові обмазок.
Металеві покриття отримують нанесенням на поверхню виробу тонкої плівки з іншого металу. Розрізняють покриття анодні і катодні. Анодні покриття виконують з металу, що стоїть в ряду напруг правіше захищається металу. Для сталевих виробів анодної захистом служить плівка з цинку, алюмінію. Якщо покриття виявиться порушеним, то руйнується покриває, а не основний метал. Цинкові і алюмінієві покриття часто застосовують для захисту поверхні закладних деталей в залізобетонних збірних конструкціях.
Катодні покриття оберігають метал від прямого контакту з корозійної середовищем. Катодний захист виконують з олова, свинцю, нікелю. Такий захист працездатна до тих пір, поки не порушена цілісність покриття. При місцевому порушенні захисної плівки почнеться корозія сталі.
Захисні плівки формують шляхом цілеспрямованої обробки деталей спеціальними хімічними реагентами. Після такої обробки на поверхні металу утворюються сполуки з великою корозійну стійкість. Захисні плівки створюють, наприклад, шляхом оксидування, обробляючи деталі в гарячому водному розчині сильних окислювачів - їдкого натру, селітри і перекису марганцю. Щільна і міцна плівка чорного кольору на поверхні стали, що складається в основному з магнітного оксиду заліза, оберігає метал від подальшого окислення. Іноді вдаються до фосфатуванню стали, обробляючи вироби розчинами фосфорної кислоти і її солей. Отримана плівка сірого кольору надійно захищає метал від корозії як на повітрі, так і в прісній воді.
Протекторна захист полягає в з'єднанні металу конструкції, що захищається з металом, який знаходиться правіше в ряді напруг.
В утвореній таким шляхом гальванічного парі метал протектора служить анодом. Він і буде поступово руйнуватися, а основний метал залишиться цілим. Даний спосіб застосовують для захисту конструкцій в морській воді, вологих ґрунтах. Сталеві конструкції опор ЛЕП, електроконтактні мережі, трубопроводів постачають протекторами у вигляді пластин з цинку, алюмінієво-цинкових або магнієвих сплавів.