Мета роботи: Визначити еквівалент металу валюмметріческім методом.
Коротка теоретична частина:
Елементи взаємодіють один з одним в суворо визначених кількісних співвідношеннях. Відповідно до закону еквівалентів, при утворенні молекулярних речовин з елементів вони з'єднуються один з одним масами, пропорційним масам їх хімічних еквівалентів.
Еквівалент- це умовна частинка речовини, яка в кислотно-основної реакції еквівалентна одному іону водню або в окисно-відновної реакції - одному електрону.
Хімічним еквівалентомтакже називається таке його кількість, яке з'єднується з 1 молем атомів водню або заміщує ту ж кількість атомів водню в хімічних реакціях.
Еквівалентна маса або молярна маса еквівалента- це маса 1 благаючи еквівалента речовини [г / моль] .е = А / В, де А - молярна маса елемента, В - стехіометрична валентність елемента.
Еквівалентом складного веществаназивается таке його кількість, яке взаємодіє без залишку з одним еквівалентом водню або з одним еквівалентом будь-якого іншого речовини.
Еквівалентна маса водородаравна1,008 г / моль, так як кожен з атомів в молекулі взаємодіє з одним атомом водню.
Еквівалентна маса кислоти дорівнює її мольной масі, поділеній на основність кислоти. Еквівалентна маса підстави дорівнює його мольной масі, поділеній на валентність металу, що утворює основу. Еквівалентна маса солі дорівнює його мольной масі, поділеній на добуток валентності металу на число його атомів в молекулі.
Еквівалент елемента може бути знайдений хімічним шляхом - визначенням кількості приєднується (заміщає) водню мул кисню або будь-якого іншого елемента, еквівалент якого відомий. Крім того, еквівалент можна визначити і електрохімічним шляхом на підставі закону Фарадея, згідно з яким при проходженні 96484 Кл електрики через розчин електроліту виділиться 1 еквівалент речовини.
Завданням даної роботи є визначення еквівалентної маси магнію за законом еквівалентів:
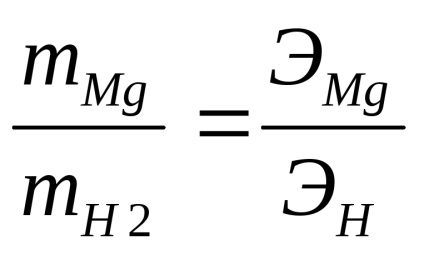
Припустимо припустити, що в умовах досвіду можна застосувати рівняння стану ідеального газу (рівняння Менделєєва-Клапейрона):
Р - тиск газу,
m- маса речовини,
М - молярна маса,
Т - абсолютна температура,
R = 8,315 Дж / К · моль - універсальна газова постійна.