Будь-яка лабораторія з тиражування міцелію повинна спиратися на лабораторію маткових культур. Ми вважаємо, що неприпустимо поєднувати в одних і тих же приміщеннях тиражування міцелію і підготовку маточного інокулюму.
У лабораторії маткових культур вирішуються наступні завдання:
• зберігання та підтримання колекції чистих культур;
• виробництво інокулюму для його тиражування;
• контроль стовбурових культур по чистоті і морфолого-культуральним параметрам.
Колекція чистих культур - це найважливіше, що має така лабораторія. Збереження стовбурових вихідних маткових культур - головне завдання ЛМК, так як всі культури, що зберігаються в вітчизняних лабораторіях отримані шляхом обміну, покупки або виділення міцелію з плодових тіл. Це означає, що жодна лабораторія в Україні і Росії не має (на сьогоднішній день) істинних маткових культур гібридів. Справжні гібриди отримують шляхом схрещування двох сортів, або сорти і дикого штаму. Спосіб отримання сорти є власністю і «know how» фірми, і оновити гібрид може тільки та фірма, яка його отримала і має вихідні батьківські форми для його виділення.
Гібриди зазвичай дуже нестійкі, тому придбані гібриди потребують професійного підходу до їх підтримці і зберігання. При кваліфікованому зберіганні і підтримці стовбурових маткових культур характерні ознаки, обумовлені генетичними особливостями сорту, повинні залишатися без змін.
СЕРЕДОВИЩА ДЛЯ ЗБЕРІГАННЯ ЧИСТИХ КУЛЬТУР
Основна мета, яку переслідують при оптимізації складу середовищ, які використовуються для зберігання, - максимально уповільнити процес метаболізму, а отже, і зростання культури. При цьому вологість середовища повинна бути така, щоб протягом року не робити пересівань через її пересихання.
Чисті культури зберігаються в пробірках на щільних поживних середовищах (рис. 1). Агар-агар - це полісахарид, отриманий з певних сортів морських водоростей. Він не є живильною речовиною і служить тільки для ущільнення середовища. У воді агар-агар плавиться при температурі 80-100 ° С, застигає при 40-45 ° С.
Мал. 1. Пробірка з агаризованому живильним середовищем
Наведемо кілька рецептів живильних середовищ:
• картопляно-глюкозний агар (г / л):
очищені та подрібнені бульби картоплі - 200 г
агар-агар - 15-20 г (або агароид 35-40г)
неохмеленное пивне сусло - 250 мл (0,25 л)
агар-агар - 15-20 г
Пивне сусло можна замінити зерновим відваром.
Для приготування картопляно-глюкозного середовища бульби картоплі відварюють до готовності, відвар фільтрують, обсяг фільтрату доводять до 1 л. Додають глюкозу, агар-агар. Середу нагрівають до повного розплавлення агар-агар.
Для приготування сусло-агарового середовища рН сусла повинно бути в межах 4-4,5.
Міцелії гливи звичайної, печериці двуспорового добре зберігаються в середовищі, де замість сусла використовується зерновий відвар, що містить всі необхідні для росту культури компоненти.
Приготовлені середовища розливають в пробірки (20x200 мм) по 10 мл. Пробірки закривають ватно-марлевими пробками. Пробка повинна входити в шийку пробірки на дві третини своєї довжини, не надто туго, але й не вільно. При розливі необхідно стежити, щоб середовище не змочила краю пробірки, інакше до них можуть прилипнути пробки. У чашки Петрі наливають по 15 мл середовища, рівномірно розподіляючи її по дну чашки.
Приготовлені середовища готові для стерилізації. Стерилізують пробірки з середовищем при тиску 1,5 атм. в автоклаві протягом 1 години. Після цього пробірки з розплавленої агарового середовищем дістають з автоклава і укладають в похилому положенні з таким розрахунком, щоб середовище не заходила за 2/3 висоти пробірки, інакше вона може змочити пробку, що неприпустимо.
Коли середовище застигне, пробірки ставлять вертикально і дають стекти воді-конденсату (чашки Петрі для цього встановлюють догори дном).
Стерилізовані середовища поміщають в термостат при 28 ° С на кілька днів. Якщо на поверхні і в товщі середовища не буде відзначений ріст бактерій або колоній цвілевих грибів, середовища вважають стерильними і передають для посіву культур.
МЕТОДИ ЗБЕРІГАННЯ ЧИСТИХ КУЛЬТУР
Існує два основні методи зберігання стовбурових маткових культур:
• метод вегетативних пасажів;
• зберігання в рідкому азоті при температурі -196 ° С.
Найбільш прийнятним і доступним для ЛМК є перший спосіб.
Нижче ми перерахуємо основні принципи зберігання, що дозволяють уникнути мутацій гібрида при зберіганні культур:
• оптимізація поживних середовищ, які використовуються для зберігання;
• використання збіднених поживних середовищ;
• скорочення частоти пасажів;
• дотримання умови зберігання, максимально уповільнюють процеси росту і метаболізму (при температурі +4. +5 "С);
• використання поживних середовищ одного складу при кожному черговому пасажі культури;
Одним з важливих параметрів зберігання є його тривалість. Відомо, що чим рідше пересівати колекція, тим менше створюється можливостей для мутацій вихідної культури. Для уникнення частих пересівань кількість одиниць кожного зберігання одного штаму повинно вистачати мінімум на рік.
Зберігання чистих культур методом вегетативних пасажів
Для підтримки культур і збереження колекції в лабораторії проводять пересів міцелію на свіжі поживні середовища. Завдяки проведенню періодичних пересівань культура постійно перебуває в роботі і проводиться контроль її чистоти.
Пробірку з культурою беруть в ліву руку на долоню паралельно розташуванню пальців і притримують великим пальцем так, щоб скошена поверхня середовища була добре видна. У праву руку (як ручку для писання) беруть інокуляціонной голку (мікологічний гачок) і кілька разів проводять нею над полум'ям пальника для стерилізації (рис. 2, а). Потім мізинцем і безіменним пальцем правої руки виймають пробку з пробірки і обережно, по стінці, для охолодження, вводять гачок. Гачком беруть невеликий шматочок міцелію (рис. 2 б). Пробірку з культурою закривають пробкою.
Беруть пробірку зі свіжої живильним середовищем. Краї пробірки і пробки проводять через полум'я пальника (рис. 2, в). На середу переносять шматочок міцелію, закривають пробкою. На пробірці з посівом обов'язково записують дату інокуляції, номер штаму, кількість пересівань.
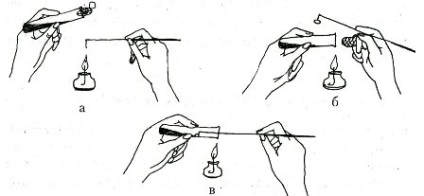
Мал. 2. Схема пересіву міцелію
Пересіяні культури поміщають в термостат при 24-26 ° С і залишають там до повного обростання культурою субстрату. Протягом перших днів бажано вести спостереження за ростом, так як в цей час легше виявити забруднення.
Метод періодичних пересівань (метод вегетативних пасажів) є найбільш поширеним методом зберігання колекційних культур. Чим рідше відбувається пересівши колекції, тим менше клітинних поділів зазнає культура і тим ближче вона за своїми властивостями до вихідного ізолятів. Для того, щоб уникнути частих пересівань, кількість одиниць зберігання повинно бути таким, щоб не довелося робити додаткових пасажів протягом терміну, на який культура закладена на зберігання. Пересівати культуру частіше, ніж раз на рік, не рекомендується. Пересіяні культури можна зберігати при кімнатній температурі, але оптимальною для зберігання культур між пересіву вважається температура 4-5 ° С.
Зберігання чистих культур в рідкому азоті при температурі -196 ° С
Відомості про зберігання культури в рідкому азоті при температурі -196 ° С ми наводимо з «Довідника мікології-грибника», Київ, «Наукова думка», 1987, с. 420-421.
Перед закладанням на зберігання міцелій витримують при температурі +5 ° С протягом 1-7 діб. Потім в одно- або двохміліметрові скляні ампули кладуть по 6-8 зерен, що обросли міцелієм, і додають 0,5 мл диметилсульфоксиду гліцерину - захисної суспензійний середовища. Перед заморожуванням ампули з міцелієм витримують при кімнатній температурі протягом однієї години. Заморожування проводять повільно, по технології, що забезпечує контроль за процесом охолодження. Заморожені культури зберігають в холодильнику з рідким азотом при темпера-турі-160. -196 ° С. Для відновлення замороженого міцелію ампули тримають на водяній бані при температурі 38 ° С, поки не зникнуть останні сліди льоду. Перед тиражуванням даний міцелій необхідно перевірити на життєздатність і силу росту. Вважають, що даний метод дозволяє зберегти штами тривалий час без істотних змін його генотипу.
ВИДІЛЕННЯ ЧИСТИХ КУЛЬТУР
Для поповнення колекції стовбурових маткових культур необхідно вміти виділяти чисті культури. Чисті культури можуть бути виділені з посівного міцелію, з плодових тіл, при пророщування базидиоспор. Ми вважаємо, що для отримання чистих культур гібридних штамів придатний тільки перший спосіб (виділення з посівного міцелію), так як тільки цей метод дозволяє отримати найбільш точну копію штаму.
Отримання чистих культур з посівного міцелію
Для отримання чистих культур з посівного міцелію беруть нерозкриту упаковку комерційного міцелію, візуально вибирають найкращий ділянка-, протирають оболонку спиртом, роблять надріз і переносять кілька зерен в пробірки зі скошеною живильним середовищем. Вся процедура проводиться в стерильному боксі. Засіяні пробірки інкубують в термостаті при температурі 24-26 ° С. Під час інкубації щодня проводять мікробіологічний контроль. Необхідно пам'ятати, що для виділення культури з комерційного міцелію потрібно користуватися тільки продукцією світових лідерів у виробництві міцелію (наприклад, фірми «Sylvan»). В такому випадку ви можете отримати культуру гібрида п'ятого покоління.
Виділення чистих культур з плодових тіл
Якщо немає можливості виділення чистої культури з комерційного міцелію провідних виробників, то у виняткових випадках можна отримати чисту культуру з плодового тіла. Виділення чистої міцелярно культури необхідно проводити з плодових тіл гібридних штамів. Для цього слід вибрати молоді неушкоджені плодові тіла. Проводити виділення краще в день збору.
Плодове тіло кладуть на фільтрувальну папір, розламують і з середини (в місці переходу ніжки в капелюшок) стерильним скальпелем відрізують шматочки тканини розміром 0,5-1 см, кожен шматочок наколюють стерильною інокуляціонной голкою, на кілька секунд опускають в стаканчик з 3-процентним розчином перекису водню і обережно, над полум'ям пальника, переносять в пробірки на живильне середовище. В кожну пробірку поміщають тільки один шматочок, що важливо для запобігання зараження. Пробірки з інокулюму поміщають в термостат при температурі 24 - 26 ° С. Вже через два дні шматочки плодового тіла в пробірках опушувалися зростаючим міцелієм. У процесі росту проводять мікробіологічний контроль.
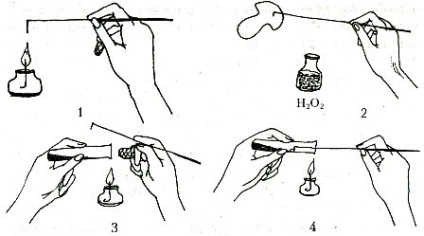
Мал. 3. Схема виділення чистих культур з плодових тіл
Виділення чистих культур з базидиоспор
Посів базидиоспор можна проводити безпосередньо з плодових тіл методом Фріза. Капелюшок гриба прикріплюють за допомогою вазеліну до внутрішній стороні кришки порожній стерильною чашки Петрі, агарове стерильне середовище розливають шаром 2-3 см в інші чашки, кришки яких по черзі на 5 хвилин замінюють кришкою з капелюшком. За цей час в чашку встигає потрапити від декількох сотень до декількох тисяч базидиоспор. Всі операції проводять в стерильному боксі або ламинарном шафі. Чашки Петрі ставлять в термостат при температурі 24-26 ° С. При проростанні базидиоспор постійно проводять мікробіологічний контроль.
Очищення міцелію від сторонніх забруднювачів
Виділені тим чи іншим способом культури можуть бути вражені колоніями цвілевих грибів, дріжджів, бактерій, що зазвичай легко помітити. Якщо поразка невелике, то можна спробувати очистити культуру. При цьому вибирають неушкоджені ділянки міцелію і стерильною інокуляціонной петлею переносять на чисте середовище з обов'язковим подальшим мікроскопічним контролем.
При необхідності можна робити кілька пересівань, щоб переконатися, що культура дійсно чиста. Перед тиражуванням такої культури її обов'язково перевіряють.
Бізнес-план: Виробництво грибів. Горемикін В.А. Богомолов А.Ю.