Гідроліз солей - оборотний процес. Для нього, як і для будь-якої іншої оборотної реакції, характерний стан рівноваги, яке може зміщуватися за принципом Ле-Шательє. Наприклад, якщо окисліться розчин солі NH4 Cl, то рівновага зміститься в ліву сторону, тобто гідроліз сповільниться:
При розведенні розчину рівновага зміститься вправо, тобто гідроліз солі посилиться.
Якщо сіль утворена Cлабо нерозчинним (або летючим) основою і слабкою летючої (або нерозчинної) кислотою, то гідроліз такої солі йде до кінця. Наприклад, Fe2 (C03) 3 в розчині не існує, так як повністю гідролізується:
У везультате випадає осад бурого кольору Fe (OH) 3 і виділяється газ С02.
Причиною гідролізу солей по катіону є зміщення рівноваги дисоціації води під дією катіонів солі в бік накопичення катіонів водню Н.
Причиною гідролізу солей за аніоном є зміщення рівноваги дисоціації води під дією аніонів солі в бік накопичення аніонів ОН -.
Причина гідролізу солей по катіону і по аніону.
Так як сіль утворена слабкою основою і слабкою, кислотою, то і катіони, і аніони солі розкладають воду:
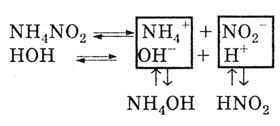
В результаті реакція середовища або нейтральна, або слабо кисла, або слабо лужна. Це залежить від ступеня дисоціації утворилися слабких кислот і підстав.
Завдання. Напишіть рівняння реакцій гідролізу:- а) хлориду амонію;
- б) ацетату натрію в молекулярному та скороченому іонному вигляді.
Вкажіть реакцію середовища. Як зміниться забарвлення лакмусу в розчинах цих солей?
Рішення, а) Хлорид амонію NH4 Cl - сіль, утворена слабкою основою NH4 OH і сильною кислотою НСl, гідролізується по катіону. Скорочена іонне рівняння:
Щоб написати молекулярне рівняння, додають іони, які не брали участі в гідролізі, але знаходяться в розчині. Це хлорид-іони:
Реакція середовища кисла. Лакмус стає червоним.
б) Ацетат натрію CH3 COONa - сіль, утворена сильною основою NaOH і слабкою кислотою СН3 СООН, гідролізується за аніоном. Цей процес можна виразити скороченим іонним рівнянням:
Додаючи відсутні катіони Na + отримують молекулярне рівняння:
Реакція середовища лужна, лакмус - синій.