Лікарська стійкість до протитуберкульозних препаратів
Лікарська стійкість до протитуберкульозних препаратів є одним з найбільш значущих проявів мінливості МБТ.
- хворі, які виділяють МБТ, чутливі до всіх протитуберкульозних препаратів;
- хворі, які виділяють МБТ, стійкі до одного протитуберкульозного препарату;
- хворі, які виділяють МБТ, стійкі до двох і більше протитуберкульозних препаратів, але не до поєднання ізоніазиду і рифампіцину;
- хворі, які виділяють для множини стійкі МБТ як мінімум до ізоніазиду і рифампіцину, які поділяються на дві підгрупи:
- хворі, які виділяють МБТ, стійкі до ізоніазиду і рифампіцину в поєднанні з іншими основними протитуберкульозними препаратами: пиразинамидом, етамбутолом і / або стрептоміцином;
- хворі, які виділяють МБТ, стійкі до ізоніазиду і рифампіцину в поєднанні з іншими основними і резервними протитуберкульозними препаратами: канамицином, етіонамідом, циклосерином, ПАСК та / або фторхінолонів.
Основними механізмами розвитку лркарственной стійкості МБТ до протитуберкульозних препаратів є мутації в гені, відповідальному за синтез білка-мішені дії препарату, або гіперпродукція метаболітів, инактивирующих препарат.
У великій і активно розмножується мікобактеріальній популяції завжди є невелика кількість лікарсько-стійких спонтанних мутантів в співвідношенні: 1 клітина мутант на 10 8 стійких до рифампіцину; 1 клітина мутант на 10 5 - до ізоніазиду, етамбутолу, стрептоміцину, канаміцину, фторхинолонам і ПАСК; 1 мутант на 10 3 - к піразинаміду, етіонаміду, кацреоміціну і циклосерин.
З урахуванням того, що в каверні величина мікобактеріальній популяції становить 10 8. там є мутанти до всіх протитуберкульозних препаратів, в той час як в осередках і осумкованних казеозних фокусах - 10 5. Оскільки більшість мутацій специфічні для окремих препаратів, спонтанні мутанти, як правило, стійкі тільки до одного препарату. Це явище називають ендогенної (спонтанної) лікарською стійкістю МБТ.
При проведенні правильної хіміотерапії мутанти практичного значення не мають, але в результаті неправильного лікування, коли хворим призначають неадекватні режими і поєднання протитуберкульозних препаратів і не дають оптимальні дози при розрахунку мг / кг маси тіла хворого, змінюється співвідношення між кількістю лікарсько-стійких і чутливих МБТ.
Відбувається природний відбір лікарсько-стійких мутантів до протитуберкульозних препаратів при неадекватній хіміотерапії, що при тривалому впливі може вести до зміни генома МБТ клітини без оборотності чутливості. У цих умовах відбувається розмноження головним чином лікарсько-стійких МБТ, ця частина бактеріальної популяції збільшується. Це явище визначається як екзогенна (індукована) лікарська стійкість.
До теперішнього часу вивчені практично всі гени МБТ, контролюючі лікарську стійкість до протитуберкульозних препаратів:
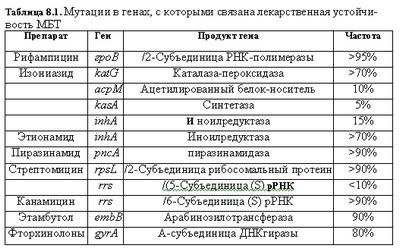
Рифампіцин впливає на ДНК-залежну РНК-полімерази (ген Гров). Стійкість до рифампіцину в переважній більшості випадків (понад 95% штамів) пов'язана з мутаціями в порівняно невеликому фрагменті. Розмір зазначеного фрагмента становить 81 пару підстав (27 кодонів). Мутації в окремих кодонах розрізняються за своїм значенням. Так, при мутаціях в кодонах 526 і 531 виявляють високий рівень резистентності до рифампіцину. Мутації в кодонах 511, 516, 518 і 522 супроводжуються низьким рівнем стійкості до рифампіцину.
Ізоніазид по суті являє собою пролекарство. Для прояву антибактеріальної активності молекула препарату повинна бути активована всередині мікробної клітини, однак хімічна структура активної форми ізоніазиду остаточно не виявлено. Активація відбувається під дією ферменту каталази / пероксидази (ген katG). Мутації в цьому гені (зазвичай в положенні 315), що призводять до зниження активності ферменту на 50%, виявляють приблизно у половини ізоніазид-стійких штамів МБТ.
Другим механізмом розвитку стійкості МБТ до ізоніазиду є гіперпродукція мішеней дії активних форм препарату. До зазначених мішенях відносяться білки, що беруть участь в транспорті попередників міколевой кислоти і її біосинтезі: ацетильований білок-носій (ген АСРМ), синтетаза (ген kasA) і редуктаза (ген inhA) білка-носія.
Міколевая кислота є основним компонентом клітинної стінки МБТ. Мутації звичайно виявляються в промоторних областях перерахованих генів. Рівень стійкості пов'язаний з гіперпродукцією мішеней і, як правило, нижче, ніж при мутаціях в генах каталази-пероксидази.
Етіонамід (протионамид) також викликає мутації в гені inhA. Це пояснюється тим, що для ізоніазиду і етіонаміла загальним попередником є нікотинамід, і стійкість до етіонаміду іноді купується разом зі стійкістю до ізоніазиду. Етіонамід є проліками і йому необхідна активація ферментом, який до цих пір не виявлено.
Піразинамід. як і ізоніазид, є проліками, так як їх загальним попередником також є нікотинамід. Після пасивної дифузії всередину мікробної клітини піразинамід перетворюється в піразіноівую кислоту під дією ферменту піразінамідази (ген рnсА). Піразіноівая кислота, в свою чергу, пригнічує ферменти біосинтезу жирних кислот. У 70-90% штамів мікобактерій, стійких до піразинаміду, в структурних або промоторних областях піразінамідази виявляють мутації.
Стрептоміцин викликає два види мутацій, що призводять до модифікації ділянки зв'язування антибіотика з малою субодиницею (I2S) рибосоми: мутації в генах, що кодують 16S рРНК (rrs), і генах, що кодують 12S рибосомальних протеїн (rspL). Є і більш рідкісна група мутацій генів рибосом, які настільки підвищують стійкість МБТ до стрептоміцину, що ці мутанти називаються стрептоміцін- залежними, оскільки зростають погано до тих пір, поки в живильне середовище не додають стрептоміцин.
Канаміцин (амікацин) викликає мутації, які кодують геном rrs, коли має місце заміна аденіну на гуанін в позиції -1400 / 6S рРНК.
Етамбутол впливає на білок етbВ (арабінозілотрансфераза), який бере участь в біосинтезі компонентів клітинної стінки МБТ. Стійкість до етамбутолу в переважній більшості випадків пов'язана з точковою мутацією в 306 кодоні.
Фторхінолони викликають мутації в генах ДНК-гірази (ген gyrA).
Отже, в клінічній практиці необхідно досліджувати лікарську чутливість і за результатами цих даних підбирати відповідний режим хіміотерапії і зіставляти його ефективність з динамікою туберкульозного процесу.
Поряд з цим виділяється первинна лікарська стійкість МБТ як стійкість, що визначається у пацієнтів, які не приймали протитуберкульозні препарати. В даному випадку мається на увазі, що хворий заразився саме цим штамом МБТ.
Первинна множинна лікарська стійкість МБТ характеризується станом мікобактеріальній популяції, що циркулює на даній території, і її показники важливі для оцінки ступеня напруженості епідемічної ситуації та вироблення стандартних режимів хіміотерапії. У Росії в даний час частота первинної множинної лікарської стійкості в окремих регіонах становить 5-15%.
Вторинна (придбана) лікарська стійкість визначається як стійкість МБТ, що розвивається в процесі хіміотерапії. Придбану лікарську стійкість слід розглядати у тих хворих, які мали на початку лікування чутливі МБТ з розвитком стійкості через 3-6 міс.
Вторинна множинна лікарська стійкість МБТ є об'єктивним клінічним критерієм неефективно проведеної хіміотерапії; в Росії вона становить 20-40%.