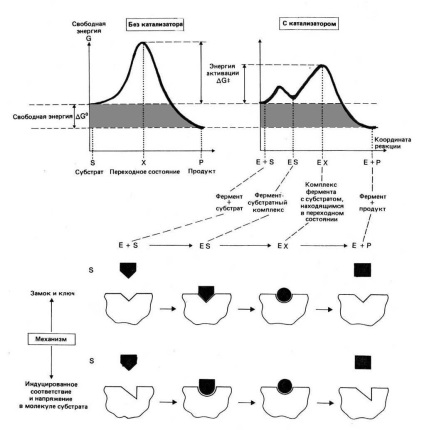
Для того, щоб змусити субстрати вступити в реакцію, необхідна енергія, вона називається енергією активації (ΔG ‡). Чим більше необхідна енергія активації, тим нижче швидкість реакції при даній температурі. Ферменти, діючи як каталізатори, знижують енергію активації, яка потрібна для того, щоб могла статися реакція. Вони підвищують загальну швидкість реакції, не змінюючи в скільки-небудь значній мірі температуру, при якій ця реакція протікає.
Фермент, з'єднуючись з субстратом, утворює короткоживучих фермент-субстратної комплекс (E-S-комплекс). У такому комплексі шанс на те, що реакція відбудеться, значно зростають. По завершенні реакції E-S-комплекс розпадається на продукт (або продукти) і фермент. Фермент в реакції не змінюється: після закінчення реакції він залишається таким же, яким був до неї, і може тепер взаємодіяти з новою молекулою субстрату.
Фермент + Субстрат → E-S-комплекс → Фермент / Продукт (и)
Способи збільшення швидкості реакції ферментами
Зниження вільної енергії перехідного стану шляхом стабілізації активованого комплексу.
Збільшення енергії субстрату, коли той зв'язується з ферментом при утворенні E-S-комплексу. В результаті зменшується різниця вільних енергій E-S-комплексу і перехідного стану.
Підтримування микроокружения активного центру в стані, відмінному від такого у водному середовищі. Часто у бічних ланцюгів амінокислотних залишків, що знаходяться в області активного центру, здатність набувати електричний заряд змінюється в порівнянні з тим випадком, коли ці ланцюги занурені у водне середовище. В результаті бічні ланцюги можуть мати "підвищеної реактивністю".
Розташування реагують атомів в правильній орієнтації і на необхідній відстані один від одного, так щоб забезпечити оптимальне протікання реакції. Зіткнення атомів у відсутності ферменту дуже рідко призводять до хімічної реакції, оскільки в цьому випадку дуже рідко атоми виявляються в правильній орієнтації.
активний центр
Молекули більшості ферментів у багато разів більше, ніж молекули тих субстратів, які активують даний фермент, причому в контакт з субстратом в E-S-комплексі вступає лише дуже невелика частина молекули ферменту - зазвичай від 3 до 12 амінокислотних залишків. Хоча ці залишки просторово зближені, в лінійній послідовності білка вони часто далеко відстоять один від одного.
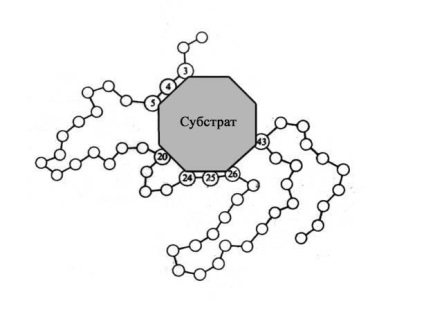
Мал. 11 Схематичне зображення Е-S-комплексу (субстрат приєднується до ферменту в активному центрі останнього).
Цю частину молекули ферменту називають активним центром. Саме тут відбувається зв'язування субстрату або субстратів.
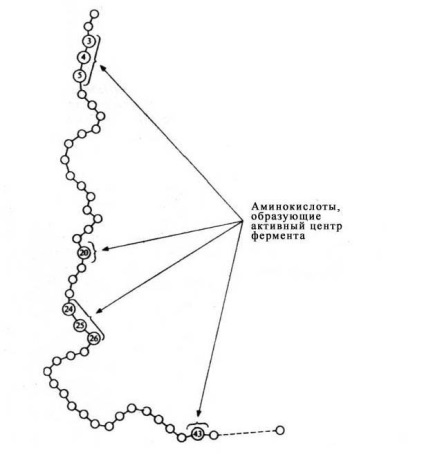
Мал. 12 Положення амінокислотних залишків, що утворюють активний центр, в первинній структурі ферментного білка).
Роль інших амінокислотних залишків, що становлять основну масу ферменту, полягає в тому, щоб забезпечити його молекулі правильну глобулярную форму, яка дуже важлива для того, щоб активний центр міг працювати найбільш ефективно.
Як правило, формування E-S-комплексу відбувається без утворення ковалентних зв'язків, а здійснюється за рахунок слабших, але і більш специфічних типів взаємодій, таких, як водневі зв'язку, сольові містки, гідрофобні сили і щільна упаковка атомів.