Ферменти знижують енергію активації хімічної реакції - розділ Філософія, Лекція 3 Ферменти. Будова, механізм дії, класифікація 1) Як І Будь Каталізатори, Ферменти Підвищують Швидкість Хім.
1) Як і будь-які каталізатори, ферменти підвищують швидкість хімічної реакції за рахунок зниження енергії активації реакції (енергетичного бар'єру) реакції.
2) Зниження енергії активації при ферментативному каталізі обумовлено збільшенням числа стадій хімічного процесу.
Індукування ряду проміжних стадій призводить до того, що вихідний бар'єр енергії активації (Еа) дробиться на кілька нижчих бар'єрів енергії активації, подолати які реагують молекули можуть набагато швидше, ніж основний.
3) Ферменти допомагають субстратів прийняти перехідний стан за рахунок енергії зв'язування при утворенні фермент-субстратного комплексу. Так, при утворенні водневих зв'язків між субстратом і ферментом при фіксації субстрату на поверхні ферменту виділяється енергія (Е а). яка витрачається на переклад молекул субстрату в активний стан.
Умовна запис реакції утворення та функціонування фермент-субстратного комплексу виглядає наступним чином:
E + S ↔ ES → EP → E + P
При взаємодії ферменту з субстратом можна виділити три стадії:
1. Перша стадія: освіту фермент-субстратного комплексу,
т. е. приєднання субстрату до макромолекулі ферменту.
2. Друга стадія. безпосередньо ферментативна реакція.
3. Третя стадія. відділення продуктів перетворення субстрату від ферменту.
Перша стадія - утворення фермент-субстратного комплексу
(E + S ↔ ES):
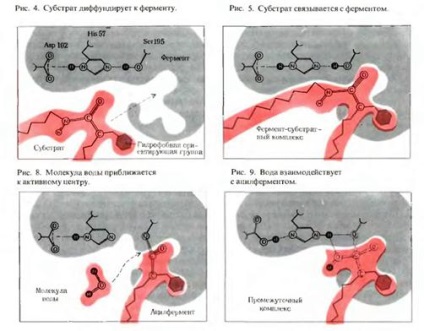
1) Взаємодії ферменту з субстратом передує зближення і орієнтація субстрату по відношенню до активного центру ферменту.
2) Потім утворюються фермент-субстратні (ES) комплекси.
Тонкий механізм формування фермент-субстратного комплексу:
а) при формуванні фермент-субстратного комплексу оборотно змінюється третинна структура (конформація) ферменту. що сприяє найкращому просторового відповідності молекул ферменту і субстрату (рис. 3.5):