Відмінною особливістю біотехнології є принцип асептики (стерильності), вирішальний наступні завдання:
1) усунення сторонньої мікрофлори з розчинів до введення в них посівного матеріалу;
2) підтримування чистоти культури на всьому протязі процесу вирощування;
3) стерилізація поживних середовищ, додаткових компонентів, титрантів, піногасники;
4) стерилізація повітря, що подається.
Основні методи стерилізації, які використовуються в біотехнологічному виробництві представлені в таблиці 1.
Найбільше значення мають термічні методи для стерилізації обладнання і середовищ, а також фільтраційний - для видалення мікроорганізмів з вводиться в біореактор повітря або іншого газу. Як правило, для стерилізації середовищ і апаратури використовують вологу термічну обробку з використанням води і пари. Така обробка більш ефективна, ніж нагрівання сухого біореактора. Найчастіше використовують стерилізацію перегрітою парою, що вводиться під тиском безпосередньо в апарат або генеруються в самому біореакторі. Якщо середовище містить білки, то реактор в цьому випадку стерилізують окремо, щоб уникнути пригорання містяться в живильному середовищі речовин на електронагрівачі.
Методи стерилізації, які застосовуються в промислової біотехнології
Необхідно знайти оптимальну температуру, при якій досягається висока надійність стерилізації і в той же час зводяться до мінімуму енерговитрати і псування матеріалу. Нагрівання може викликати хімічні перетворення компонентів живильного середовища. При 100 ° С і вище карбонільні групи цукрів взаємодіють з іонами амонію або аминогруппами амінокислот і білків. При цьому утворюються продукти, які є інгібіторами росту клітин. Щоб уникнути цього, необхідно окремо стерилізувати компоненти живильного середовища.
Розкладання ряду речовин, наприклад, моносахаров і вітамінів, змушують обмежити час і температуру для термічної стерилізації, а іноді зовсім відмовитися від неї. Тому застосовують хімічні дезінфікуючі речовини або фільтрацію рідин. Фільтри, однак, швидко забиваються клітинами мікроорганізмів і іншими зваженими частинками.
У великотоннажних виробництвах поживні субстрати стерилізують періодичним і безперервним методом. При періодичному методі стерилізацію проводять в ферментере. Середу нагрівають до температури стерилізації (128-135ºС), витримують при цій температурі 20-30 хвилин і охолоджують до температури ферментації. Економічно вигідніший безперервний спосіб стерилізації. Нагрівання середовища проводять в колонах, парових ежекторах, теплообмінниках. Тривалість витримування середовища повинна гарантувати інактивацію вегетативних клітин і спор.
У лабораторних умовах для стерилізації обладнання і поживних середовищ застосовують термічні методи: автоклавирование, кип'ятіння, пастеризацію, прожарювання.
Прожарювання. або флашбірованіем, стерилізують безпосередньо перед вживанням бактеріологічні петлі, голки, шпателі, дрібні металеві предмети (ножиці, пінцети), а також скляні палички, предметні. покривні скла.
Стерилізацію сухим жаром застосовують для обробки посуду і сухих матеріалів, наприклад, крейди, крохмалю. Нагрівання проводять протягом 2 годин при 170ºС в сухожарові або електросушильні шафах. Температура вище 170ºС не рекомендується: ватні пробки і папір починають руйнуватися. Після закінчення стерилізації шафа відкривають тільки після того як температура в ньому знизиться до кімнатної, інакше під дією холодного повітря скло може лопнути.
Стерилізація текучим паром (100 º) обробляють предмети, що псуються від сухого спека, і деякі поживні середовища, які не витримують більш високої температури (середовища з вуглеводами, молоко). Дану стерилізацію називають дробової і виробляють протягом трьох днів (по 30 хв щодня) в кип'ятильник Коха або на водяній бані. При одноразовому прогріванні при температурі 100 ° С за 30 хв гинуть вегетативні клітини, спори мікроорганізмів залишаються життєздатними. Після прогріву середу поміщають на 24 години в термостат при 28-30ºС. Спори, що збереглися при першому нагріванні, встигають за цей час прорости в вегетативні форми, які гинуть при подальшому нагріванні. Операцію повторюють три рази.
Стерилізація насиченою парою під тиском - найбільш швидкий і надійний спосіб термічної стерилізації, при якому гинуть самі стійкі спори. Таким чином стерилізують більшість поживних середовищ. Цей спосіб заснований на прогріванні субстрату насиченою парою під тиском вище атмосферного. Обробку насиченою парою виконують в герметично закривається товстостінній котел - автоклаві. Автоклав являє собою металевий двостінний апарат (рис.2), внутрішня частина якого служить стерилізаційної камерою (1), куди поміщають стерилізується матеріал.
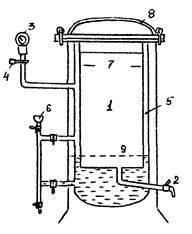
Рис.2. Схема автоклава. 1 - стерилізаційна камера; 2 - кран для виходу повітря; 3 - манометр; 4 - запобіжний клапан; 5 - Водопаровой камера; 6 - воронка для заповнення автоклава водою; 7 - отвір для надхо-ня пара в стерилизационную камеру; 8 - кришка автоклава; 9 - підставка для стерилізується матеріалу.
Стерилізаційна камера забезпечена краном (2) для виходу повітря, манометром (3) для визначення тиску пари і запобіжним клапаном (4) для виходу пари при підвищенні тиску понад необхідне. Водонапірна камера (5) через воронку (6) заповнюється дистильованою водою до мітки на водомірної трубці. Манометр показує, на скільки тиск пара всередині котла вище атмосферного. Показниками манометра в фізичних атмосферах відповідає певна температура. Кожен мікроорганізм має свій температурний оптимум. Спори мікроорганізмів більш терморезистентность і є лімітуючим фактором, що визначає температурний режим стерилізації середовищ.
Компоненти поживних середовищ по-різному реагують на термічний вплив. Щоб уникнути їх небажаних деструктивних змін застосовують по можливості більш м'які режими стерилізації або роздільну стерилізацію компонентів.
Пастеризація є неповну, або часткову, стерилізацію, що означає нагрівання при 65-80ºС протягом 30 хвилин з наступним швидким охолодженням до 10-11ºС.
Стерилізація фільтруванням через дрібнопористі фільтри застосовують для обробки середовищ, компоненти яких легко розкладаються при нагріванні. Через дрібні пори фільтра можуть пройти тільки дрібні мікроорганізми (віруси, бактеріофаги).
Найбільш часто використовують фільтри з каоліну, що представляють собою порожнисті целиндра, закриті з одного боку. Щоб рідина пройшла через такий фільтр, необхідно створити різницю тиску по обидва боки циліндра. Цього досягають негнетаніем або відкачуванням повітря за допомогою масляних насосів. Фільтр з'єднують з приймачем для рідкого середовища - колбою Бунзена. Відтягнутий кінець колби закривають ватним корком. Фільтр з приймачем стерилізують. Середу для стерилізації наливають в посудину, в який поміщають фільтр, а колба Бунзена з ватно-марлевою пробкою з'єднують з насосом і викачують повітря. Рідина під тиском проходить через фільтр в приймач. Бактерії залишаються з зовнішнього боку фільтра. Незручність методу полягає в повільній фільтрації і необхідність частого очищення фільтрів.
ПОРЯДОК ПРОВЕДЕННЯ РОБОТИ
1.Приготувати ватно-марлеву пробку для стерилізації флакона або пробірки.
2.Підготувати до стерилізації (загорнути в щільний папір) 4 чашки Петрі. Запробковать і загорнути в паперову смужку піпетки.
3.Пріготовіть по заданій викладачем методикою щільну живильне середовище.
4.Простерілізовать приготовлену живильне середовище на водяній бані дробовим методом.
5.Пріготовіть стерильний 0,89% розчин хлориду натрію (фізіологічний розчин).
4. ОБЛАДНАННЯ І РЕАКТИВИ, ВИКОРИСТОВУЮТЬСЯ ПРИ ВИКОНАННІ ЛАБОРАТОРНОЇ РОБОТИ: