Молярна маса сірководню
Сірководень (моносульфан) в звичайних умовах являє собою безбарвний газ.
Термічно нестійкий. Будова молекули представлено на рис. 1.Плохо розчинний в холодній воді. Насичений розчин (0,1) називають «сірководневою водою», який мутніє при стоянні на повітрі. Виявляє слабкі кислотні властивості. В ОВР є сильним відновником.
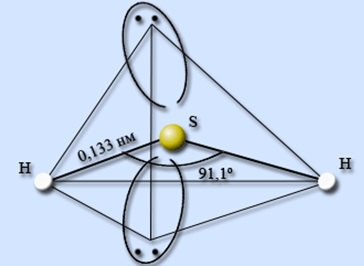
Мал. 1. Будова молекули сірководню із зазначенням валентного кута між зв'язками і довжини хімічних зв'язків.
Брутто-формула сірководню - H2 S. Як відомо, молекулярна маса молекули дорівнює сумі відносних атомних мас атомів, що входять до складу молекули (значення відносних атомних мас, узятих з Періодичної таблиці Д. І. Менделєєва, округлимо до цілих чисел).
Mr (H2 S) = 2 × Ar (H) + Ar (S);
Mr (H2 S) = 2 × 1 + 32 = 2 + 32 = 34.
Молярна маса (М) - це маса 1 моль речовини. Легко показати, що чисельні значення молярної маси М і відносної молекулярної маси Mr рівні, однак перша величина має розмірність [M] = г / моль, а друга безрозмірна:
Це означає, що молярна маса сірководню дорівнює 34 г / моль.
Приклади розв'язання задач
Складіть формулу сполуки водню, сірки і кисню, якщо масові частки елементів в ньому: ω (H) = 2,04%, ω (S) = 32,65%, ω (O) = 65,31%.
Масова частка елемента Х в молекулі складу НХ розраховується за такою формулою:
ω (Х) = n × Ar (X) / M (HX) × 100%.
Позначимо кількість моль елементів, що входять до складу з'єднання за «х» (водень), «у» (сірка), «z» (кисень). Тоді, мольное ставлення буде виглядати наступним чином (значення відносних атомних мас, узятих з Періодичної таблиці Д. І. Менделєєва округлимо до цілих чисел):
x: y: z = ω (H) / Ar (H). ω (S) / Ar (S). ω (O) / Ar (O);
x: y: z = 2,04 / 1. 32,65 / 32: 65,31 / 16;
x: y: z = 2,04. 1,02: 4,08 = 2. 1. 4.
Значить формула сполуки водню, сірки і кисню матиме вигляд H2 SO4. Це сірчана кислота.
Складіть формули двох оксидів міді, якщо масові частки міді в них 79,9% і 88,8%.
Масова частка елемента Х в молекулі складу НХ розраховується за такою формулою:
ω (Х) = n × Ar (X) / M (HX) × 100%.
Знайдемо масову частку в кожному з оксидів міді:
ω1 (О) = 100% - ω1 (Cu) = 100% - 79,9% = 20,1%;
ω2 (О) = 100% - ω2 (Cu) = 100% - 88,8% = 11,2%.
Позначимо кількість моль елементів, що входять до складу з'єднання за «х» (мідь) і «у» (кисень). Тоді, мольное ставлення буде виглядати наступним чином (значення відносних атомних мас, узятих з Періодичної таблиці Д. І. Менделєєва округлимо до цілих чисел):
x: y = 79,9 / 64. 20,1 / 16;
x: y = 1,25. 1,25 = 1. 1.
Значить формула першого оксиду міді матиме вигляд CuO.
x: y = 88,8 / 64. 11,2 / 16;
x: y = 1,39. 0,7 = 2. 1.
Значить формула другого оксиду міді матиме вигляд Cu2 O.