Загальні відомості про валентності нікелю
Нікель - елемент четвертого періодаVIII групи побічної (B) підгрупи Періодичної таблиці. Метал. Позначення - Ni. Порядковий номер - 28.
У вигляді простого речовини нікель - блискучий білий метал з сріблястим відтінком. Щільність 8,91г / см 3. Температура плавлення 1455 o С, кипіння 2900 o С.
Нікель має дві аллотропние модифікації. Нижче 250 o С стійкий α-нікель з гексагональної гратами, вище 2500 o С - β-нікель з гранецентрированной кубічної гратами.
Валентність нікелю в з'єднаннях
Нікель - двадцять восьмий за рахунком елемент Періодичної таблиці Д.І. Менделєєва. Він знаходиться в четвертому періоді в VIIIв групі. В ядрі атома нікелю міститься 28 протонів і 31 нейтрон (масове число дорівнює 59). В атомі нікелю є чотири енергетичних рівня, на яких знаходяться 28 електронів (рис. 1).
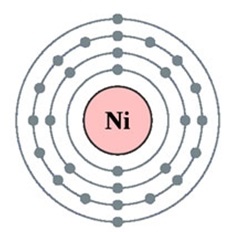
Мал. 1. Будова атома нікелю.
Електронна формула атома нікелю в основному стані має наступний вигляд:
А енергетична діаграма (будується тільки для електронів зовнішнього енергетичного рівня, які по-іншому називають валентними):
Наявність двох неспарених електронів свідчить про те, що нікель проявляє в своїх з'єднаннях валентність II (NiO, Ni (OH) 2. NiCl2. NiBr2). Відомо, що для нікелю також характерна валентність III (Ni2 O3. NiOOH).
Приклади розв'язання задач
Напишіть рівняння реакцій, за допомогою яких можна здійснити такі перетворення:
Рівняння реакцій, що протікають в розчинах, покажіть в іонної і скороченою іонної формах.
Помістивши в розчин хлориду нікелю (II) більш активний, ніж нікель метал, можна отримати нікель у вільному вигляді (реакція заміщення):
Ni 2+ + Zn o → Ni o + Zn 2+.
Нікель розчиняється в розведеною сірчаної кислоти з утворенням сульфату нікелю (II):
Ni o + 2H + → Ni 2+ ++ H2.
Нітрат нікелю (II) можна отримати за реакцією обміну:
Подіяв на нітрат нікелю (II) лугом можна отримати гідроксид нікелю (II):
Ni 2+ + 2OH - = Ni (OH) 2 ↓.
Хлорид нікелю (II) з гідроксиду нікелю (II) можна отримати за реакцією нейтралізації з соляною кислотою: