Спонсор конкурсу - далекоглядна компанія Life Technologies.
Wnt-шлях - один з найважливіших молекулярних сигнальних шляхів, який регулює ембріональний розвиток і диференціювання клітин. Весь шлях названий по імені одного з лігандів, який активує шлях в клітинах - Wnt. Це скорочення відбулося від злиття назв двох генів - W g + Int. Прототип гена був відкритий у дрозофіли, де мутація в гені Wg (w ing less) придушувала розвиток крил. Гомологічний ген у хребетних - Int - пов'язаний з розвитком ракових пухлин.
На сьогоднішній день відомо, що Wnt-шлях регулює розвиток багатьох органів під час ембріогенезу і відповідає за білатеральну симетрію організму. Його функції - все те, що формує з маси ембріональних клітин сформований організм. У дорослих особин порушення Wnt-шляхи ведуть до підвищеного ризику ракових захворювань. Також недавні роботи показали важливу роль компонентів Wnt в проліферації і диференціації стовбурових клітин.
Глікопротеїни Wnt - це сімейство секретується клітинами сигнальних молекул, які беруть участь в координації поведінки клітин в організмі. Ці білки, відкриті ще на початку 1980-х в якості маркерів багатьох видів ракових захворювань, виявилися ключовими регуляторами ембріонального розвитку, процесів регенерації, зростання кісток, диференціювання стовбурових клітин і маси інших процесів, пов'язаних з морфогенезом і визначенням клітинної долі.
Структура Wnt білків
Структура білків сімейства Wnt нагадує кисть руки (рис. 1; [1]). Роль великого пальця грає аміноконцевой домен, що складається з пучка α-спіралей, стабілізованих п'ятьма дисульфідними містками. «Вказівний палець» - карбоксіконцевой домен, що включає два β-тяжа, підтримуваних шістьма дисульфідними містками. «Пальма» володіє високою гнучкістю, забезпечуючи конформаційну рухливість білка. Крім цього, до «великого пальця» ковалентно приєднується пальмітолеіновая жирна кислота, необхідна для взаємодії з транспортними білками. Приєднання залишку жирної кислоти називається ацилированием. і залежить воно від іншої модифікації ділянки «долоні» - глікозилювання. Без нього стає неможливим взаємодію з транспортними білками і, отже, секреція.
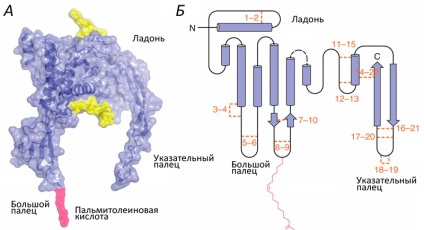
Малюнок 1. Структура Wnt.A. Об'ємна модель Wnt8. Жовтим кольором позначені глікозильовані ділянки. Б. Вторинна структура Wnt. Помаранчевим кольором позначені і пронумеровані 22 залишку цистеїну, які утворюють парні дисульфідні містки. Рожевим кольором позначена ковалентно приєднана ацильного група: жирна кислота. Картинка: [2, 3].
секреція Wnt
Передбачається, що приєднання необхідного для секреції Wnt залишку жирної кислоти здійснює ацілтранферраза ЕПР Поркупін (PORCN), так як делеция цього гена порушує секрецію Wnt (рис. 3; [4]). Після ацилирования Wnt розпізнається білками апарату Гольджі - трансмембраним рецептором GPR177 (широко відомим як Wntless (Wls)), «білками-вантажниками» p24, які переносять Wnt від ЕПР на поверхню клітини (рис. 3; [5]) і транспортним білком Swim , який підтримує розчинність і сигнальну активність компллекси Wnt / Wls [6].
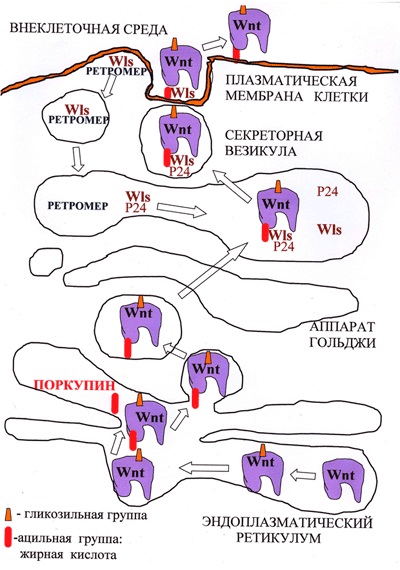
Малюнок 2. Біогенез і секреція Wnt. Молекули Wnt в процесі дозрівання в ЕПР піддаються Глікозилювання, а потім ацилированием. Потім у супроводі білка Wntless з апарату Гольджі вони потрапляють в секреторні везикули, всередині яких перетинають плазматическую мембрану, після чого секретируются. Wntless витягується з відпрацьованих секреторних везикул і переноситься назад в апарат Гольджі за допомогою комплексу Retromer.
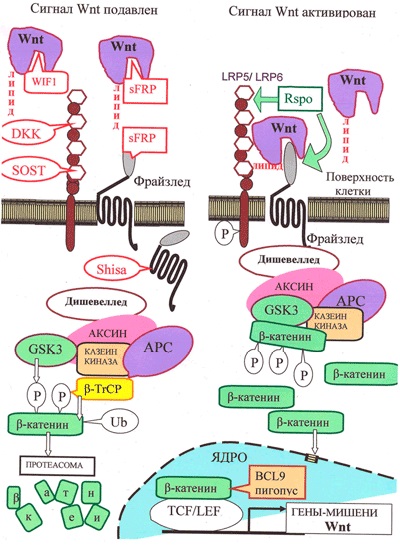
Малюнок 3. Канонічний шлях Wnt-сигналізації. «Робочим тілом» канонічного шляху є β-катенин: в неактивному стані його мало, а в активному - багато, і він активує транскрипцію в ядрі.
Неактивний стан: у відсутності взаємодії між Wnt і рецептором LRP5 / 6 кількість цитоплазматичного β-Катенін малó за рахунок «деградаційної комплексу», що складається з білків APC, казеінкінази і глікоген-синтези-кінази GSK3, розташованих на «платформі» білка Ксенія. За допомогою цього комплексу цитоплазматический β-катенин фосфорилируется, а потім піддається убіквітілірованію білком β-TrCP, що призводить до його деградації за допомогою протеасоми.
Активований стан: Wnt-сигнал починається з освіти комплексу Wnt з LRP5 / 6 і рецептором Фрайззлед (Frizzled), що призводить до активації білка Dishevelled. Це пригнічує «деградаційний комплекс» і «вимикає» убіквітілірованіе β-Катенін. В результаті накопичується в цитоплазмі вільний β-катенин [16] проникає в ядро і активує транскрипцію за допомогою транскрипційних факторів TCF / LEF і ряду інших.
Регуляція шляху Wnt: з секретується молекулами Wnt безпосередньо зв'язуються їх антагоністи: Wnt-інгібуючий фактор (WIF) і Фрайззлед-довідається білок 1 (sFRP). Крім того, для запобігання утворення комплексу Фрайззлед-Wnt-LRP, c білками LRP5 / LRP6 можуть зв'язатися DKK і склеростін. Білки Shisa, захопивши рецептор Фрайззлед, заважають йому вийти на поверхню клітини. Якщо Wnt утворює комплекс з LRP5 / 6 і Фрайззлед, сигналізація активується. Білок R-spondin 2 (RSPO), стабілізуючи рецептори Фрайззлед і LRP5 / 6, підвищує сигналізацію по шляху Wnt. В ЕПР для дозрівання LRP5 / 6 необхідний супроводжуючий білок MESD.
Мембранні рецептори Wnt
Для того щоб впливати на клітину-мішень, Wnt повинен зв'язатися з клітинними рецепторами. В якості таких рецепторів на поверхні клітини виступають трансмембранний білок Фрайзлед Frizzled (Fz) * та ліпопротеїди низької щільності LRP5 / LRP6. Зв'язатися з ними молекулі Wnt активно заважають різні антагоністи, яким протистоять агоністи (рис. 3). Крім цих рецепторів Wnt може зв'язуватися з рецепторними тирозинкіназ Ror і Ryk *. Ror, зв'язавшись з Wnt5a, фосфорилирует білок Дішевеллед і таким чином контролює морфогенез тканин, тоді як Ryk, фосфоріліруя мембранний білок Vangl2, контролює полярність клітини.
Механізми впливу Wnt на клітку
За традицією механізми впливу Wnt на клітку поділяють на:
- канонічний (β-катенин-залежний) шлях, який, в кінцевому рахунку, контролює програми генної експресії, пов'язані з визначенням долі клітини і морфогенезом [9]. і
- неканонічні (β-катенин-незалежні) шляху [10]. які регулюють полярність клітини, стимулюючи реорганізацію цитоскелету [11, 12] і метаболізм кальцію [13].
В основі канонічного шляху Wnt-сигналізації лежить стабілізація цитоплазматического білка β-Катенін (рис. 3). За відсутності сигналу β-катенин не активний і швидко деградує. Коли клітини активуються Wnt, швидкість деградації β-Катенін знижується. Уникнув деградації β-катенин накопичується в цитоплазмі і входить в ядро.
В ядрі β-катенин, захопивши ядерні білки BCL9 і пігопус (Pygopus), взаємодіє з білками TCF / LEF. перетворюючи їх в потужні активатори транскрипції. TCF / LEF є многофукціональнимі білками, які, володіючи здатністю вибірково зв'язуватися з певними послідовностями ДНК і з певними білками-активаторами, «приймають рішення», які з генів будуть активовані сигналом Wnt [14]. Виявлено, що зв'язок між β-Катенін і TCF 4, необхідна для такої активації, може бути порушена ресвератролом. Це дозволяє припустити, що ресвератрол, який є флавоноїдом шкірки чорного винограду і отримуваного з нього вина, може бути використаний в якості нешкідливого ліки для придушення сигналу Wnt при ракових захворюваннях [15].
Вплив Wnt-сигналізації на клітинний цикл і проліферацію клітин
З'являється все більше доказів складному взаємозв'язку канонічного шляху Wnt-сигналізації і клітинного циклу. Компоненти сигнального каскаду Wnt діють безпосередньо на формування мітотичного веретена. Так, наприклад, у улюбленого модельного організму молекулярних біологів - черв'ячка C. elegans - сигналізація Wnt викликає асиметрію митотического веретена, що приводить до асиметричному розподілу β-Катенін [17]. Більш того, сигналізація Wnt сильно активується в мітозі, бо свідчить про те, що «митотическая Wnt-сигналізація» грає важливу роль в організації програми клітинного ділення і таким чином сприяє клітинної проліферації [18].
Стовбурові клітини в основному характеризуються двома властивостями: здатністю до самовідновлення і диференціювання в різні типи клітин *. Ці процеси регулюються різними факторами зростання, в тому числі білками Wnt [19]. Накопичені дані показують, що сигнальний шлях Wnt / β-Катенін грає ключову роль в підтримці плюріпотентності, а також в процесах перепрограмування соматичних клітин. У той же час сигналізація Wnt / β-катенин грає важливу роль і в процесі диференціювання.
Виявлено, що додавання білка Wnt або ж, навпаки, інгібітору Wnt (малої молекули IWP2) знижує неоднорідність популяції клітин. При цьому утворюються або клітини зі стабільно високим рівнем синтезу Wnt, або клітини з низьким рівнем синтезу Wnt. При диференціюванні ембріональні клітини з високим рівнем синтезу Wnt переважно утворюють ентодермальні і серцеві клітини, а з низьким - в першу чергу нейроектодермальні клітини [23]. Знання того, що сигналізація Wnt на ранніх стадіях диференціювання підвищує, а на пізніх стадіях навпаки пригнічує розвиток серця, дозволило шляхом правильної стратегії використання малих молекул і механізмів сигналізації Wnt отримати in vitro з індукованих плюрипотентних стовбурових клітин людини кардіоміоцити з недосяжною досі ефективністю - до 98% [24]!
перспективи
Ось уже 30 років як щорічно утворюється велика кількість статей, так чи інакше зачіпають тему сигналізації Wnt. Така пильна увага до цієї теми цілком заслужено, бо «всюдисуща» молекула Wnt регулярно підносить сюрпризи. Так, наприклад, з'ясувалося, що β-катенин, уникнув деградації завдяки активації Wnt-сигналу, активує синтез ферментативної субодиниці теломерази (TERT) в стовбурових і ракових клітинах. У цьому йому допомагає один з транскрипційних факторів плюріпотенціі - Klf4, що направляє його на промотор гена Tert [25]. Як відомо, теломераза - фермент, що підтримує довжину теломерів на противагу їх вкорочення, що приводить до старіння клітини [26]. Тому відкриття ролі Wnt в стабілізації теломер може допомогти як боротьбі з раковими захворюваннями, так і боротьбі зі старінням.