Ненасичені вуглеводні ряду етилену. або алкени, - це вуглеводні із загальною формулою Cn H2n. молекули яких містять одну подвійну зв'язок. Атоми C, пов'язані подвійним зв'язком, знаходяться в стані sp 2-гібридизації, подвійний зв'язок є поєднанням - і - зв'язків. За своєю природою - зв'язок різко відрізняється від -Зв'язку; - зв'язок менш міцна внаслідок перекривання електронних хмар поза площиною молекули.
Найпростішим алкенами є етилен. Структурна і електронна формули етилену мають вигляд:
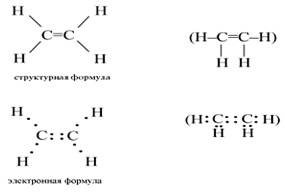
У молекулі етилену піддаються гібридизації одна s - і дві p орбіталі атомів C (sp 2-гібридизація). Таким чином, кожен атом C має по три гібридних орбіталі і по одній негибридная p орбіталі. Дві з гібридних орбіталей атомів C взаємно перекриваються і утворюють між атомами C-зв'язок. Решта чотири гібридних орбіталі атомів C перекриваються в тій же площині з чотирма s орбіталь атомів H і також утворюють чотири-зв'язку.
Дві негібридних p орбіталі атомів C взаємно перекриваються в площині, яка розташована перпендикулярно площині -зв'язків, тобто утворюється одна-зв'язок. Під дією реагентів-зв'язок легко розривається.
Етилен - перший член гомологічного ряду алкенів.
Але молекула бутена -2 може перебувати у вигляді двох просторових форм - цис- і транс-:
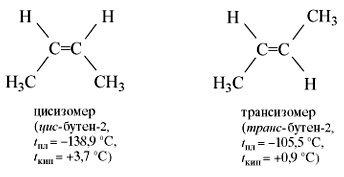
Цис- і транс-ізомери, маючи різне розташування атомів в просторі, відрізняються багатьма фізичними і хімічними властивостями. Таким чином, для алкенів можливі два види структурної ізомерії. ізомерія вуглецевого ланцюга і ізомерія положення подвійного зв'язку. Можлива також геометрична ізомерія. Етилен (етен) - безбарвний газ з дуже слабким солодкуватим запахом, трохи легший за повітря, малорастворим в воді.
За хімічними властивостями етилен різко відрізняється від етану, що обумовлено електронною будовою його молекули. Маючи в молекулі подвійну зв'язок, що складається з - і -зв'язків, етилен здатний приєднувати два одновалентних атома або радикала за рахунок розриву-зв'язку.
Здатність до реакцій приєднання характерна для всіх алкенов.
При додаванні до алкенів брому (у вигляді бромної води) буре забарвлення брому швидко зникає. Ця реакція є якісною на подвійну зв'язок.
Якщо вихідний алкен несиметричний, то реакція протікає за правилом Марковникова.
Приєднання галогеноводородов до ненасичених сполук йде по іонному механізму.
4. Приєднання води (реакція гідратації):
Цією реакцією користуються для отримання етилового спирту в промисловості.
Для алканів характерні реакції окислення:
1. етилен легко окислюється вже при звичайній температурі, наприклад при дії перманганату калію. Якщо етилен пропускати через водний розчин перманганату калію KMnO4. то характерна фіолетове забарвлення останнього зникає, відбувається окислення етилену перманганатом калію (якісна реакція на подвійний зв'язок):
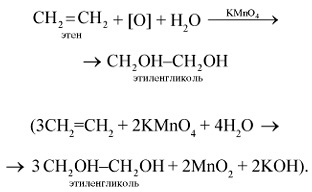
2. Етилен горить світловим полум'ям з утворенням оксиду вуглецю (IV) і води:
3. Велике промислове значення має часткове окислення етилену киснем повітря:
Для етилену, як і для всіх ненасичених вуглеводнів, характерні реакції полімеризації. Вони протікають при підвищеній температурі, тиску і в присутності каталізаторів:
Полімеризація - це послідовне з'єднання однакових молекул у більш великі.
Таким чином, для етилену і його гомологів характерні реакції приєднання, окислення і полімеризації.