
Ядро атома оточене електронними орбиталями, кожна з яких містить максимум по 2 електрони з різними спінові квантовими числами. Атом водню має одну зовнішню орбиталь, атоми азоту, вуглецю і кисню мають по 4 зовнішні орбіталі, захоплюючі 8 електронів. Атоми більш стабільні, коли орбіталі заповнені електронами. Вільні радикали -це високоактивні молекули або атоми, що мають неспарені електрони на зовнішній орбіталі, які не задіяні в утворенні хімічного зв'язку. Атоми або невеликі молекули, які є вільними радикалами, більш нестабільні, ніж великі, тому що останні можуть захоплювати електрон для освіти резонансної структури (тобто стабільну структуру).
Вільні радикали можуть пошкоджувати нуклеїнові кислоти, білки і ліпіди. Для біологічних систем найбільш важливі кисневі вільні радикали, зокрема, супероксід- аніон (superoxide (.O2-)), оксид азоту (nitric oxide (.NO)) і гідроксильний радикал (hydroxyl radical (.OH)). Оксид азоту щодо неактивний радикал, який живе всього кілька секунд, швидко реагуючи з киснем. Але якщо він взаємодіє з супероксід- аніоном, то образуестя пероксинітрит (peroxynitrite (ONOO-)), який розкладається з утворенням гідроксильного радикала. Пероксинітрит, як і гідроксильний радикал, реагують безпосередньо з білками і іншими макромолекулами з утворенням альдегідів і кетонів, поперечних зшивок і продуктів перекисного окислення ліпідів. Тільки 1-4% однониткових розривів ДНК провокується пероксінітріта і гідроксильних радикалом. Крім того, перекис водню (hydrogen peroxide (H2O2)) і гіпохлорит (hypochlorite (OCl-)) самі по собі не є вільними радикалами, але ці кисень- містять молекули можуть полегшувати утворення вільних радикалів. Всі ці кисень- містять молекули об'єднані терміном активні форми кисню (АФК, ROS). АФК діють на заснування в складі нуклеїнових кислот, амінокислот бічних ланцюгів білків і подвійні зв'язку в ненасичених жирних кислотах.
Пошкодження макромолекул (і клітини в цілому) в результаті дії АФК називається оксидативного стресу.
Вироблення АФК в мітохондрії
Оксидативного ушкодження ДНК
В одно- і двунітевих розривах,
освіті ап сайтів (тобто втрата підстави- пиримидина або пурину),
пошкодженні підстав і цукрів, що входять до складу ДНК.
Гідроксильний радикал викликає іонізацію основ ДНК. Крім того, важливу роль відіграють ненасичені жирні кислоти. Після перекисного окислення вони утворюють стабільні похідні, які приєднуються до нуклеїнової кислоти, утворюючи ДНК аддукти (з'єднання), зчитування яких утруднено. Також утворюються зшивання ДНК ДНК і ДНК-білок. Як уже згадувалося, в процесі ушкодження ДНК утворюються модифіковані підстави:
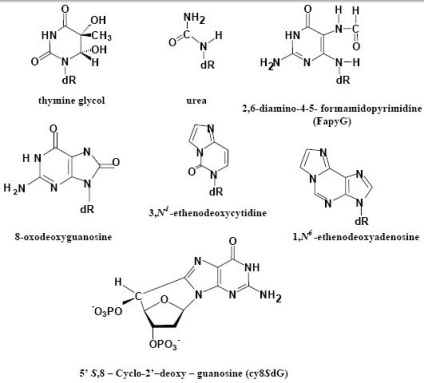
Агенти, які пошкоджують ДНК, також пошкоджують і РНК і вільні нуклеотиди. Пуринів і піримідинів в 100-1000 разів чутливіші до модифікації у вигляді мононуклеозідов і нуклеотидів, ніж в складі ДНК і РНК, де вони захищені спіральною структурою. Модифікація пулу нуклеотідов- це один з важливих факторів ушкодження нуклеїнових кислот. Хоча ДНК і РНК-полімерази розпізнають пошкоджені і модифіковані підстави, це розпізнавання недостатньо і вони можуть вбудувати порежденние нуклеотиди в нерухомість, що будується нуклеїнових кислот.
Пошкодження промоторних областей генів
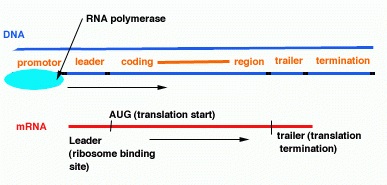
Промотор - послідовність нуклеотидів ДНК, впізнавана РНК-полімерази як стартовий майданчик для початку специфічної, або осмисленої, транскрипції. У прокаріотів промотор включає ряд мотивів, важливих для впізнавання його РНК-полімерази, зокрема так звані послідовності -10 і -35. Промотор асиметричний, що дозволяє РНК-полімерази почати транскрипцію в правильному напрямку і вказує те, яка з двох ланцюгів ДНК буде служити матрицею для синтезу РНК. Промоторних ділянку в межах оперона може частково перекриватися або зовсім не перекриватися з операційним ділянкою цистрона (гена). У еукаріот, до яких відноситься і людина, немає оперонов, але транскрипція так само починається з промотора. Крім того, промотори транскрипційно активних генів не захищені нуклеосомами, тому більш схильні до окислення підстав. Також, промотори багаті легко окислювальними і важко репаріруемимі GC-послідовностями (при взаіммодействіі з радикалами легко утворюється 8 оксо-гуанін).
У зв'язку з важливістю промоторної ділянки, будь-яка мутація в ньому може призвести до неправильного зчитування або неможливості транскрипції цього гена, що в свою чергу призводить до неправильного синтезу функціонального білка. такий процес може лежати в основі виникнення різних захворювань.
Роль оксидативного ушкодження ДНК в процесі старіння і виникнення захворювань
Онкологічне захворювання
Рак- це генна хвороба. З цієї точки зору кожен фактор, який взаємодіє з ДНК і модифікує її, є канцерогеном. Отже АФК мають мутагенну, канцерогенну дію. Одним з найбільш досліджуваних в даний час маркерів ушкодження є 8-оксогуанін (8-oxoGua). Його присутність у складі ДНК призводить до GC-TA заміні, якщо не репаруючу до реплікації. Наприклад, при дослідженні рівня 8-оксогуаніна в клітинах міоми матки було з'ясовано, що цей рівень корелює з розміром пухлини. Зростаючий рівень модифікованих підстав викликає нестабільність геному і збільшує потенціал метастазування в сформувалася пухлини. Це було показано в дослідженнях на деяких видах аденокарциноми.
Оксидативним пошкодженням пояснюється існування безлічі різних мутацій в одній клітці карциноми, з розвитком пухлини число цих мутацій збільшується. Розумно припустити, що вони виникають в процесі розвитку пухлини. Тут грають роль внутрішньоклітинні процеси (окисне фосфорилювання, метаболізм жирних кислот в пероксисомах, реакції за участю цитохрому P450, "респіраторний вибух" в фагоцитах), які є основним джерелом вільних радикалів, що викликають зміну підстав, а отже і мутації, що призводять до виникнення раку.
атеросклероз
Пошкодження ДНК мають важливе значення в патогенезі атеросклерозу. В деякій мірі атеросклеротическое пошкодження тканин ініціюється мутаціями, так само як і при раку. Існують дані, що в тканинах аорти, ураженої атеросклеротичним процесом, виявлений високий рівень 8-оксогуаніна, що може бути однією з причин захворювання.
Окислений ліпопротеїн низької щільності (ЛПНЩ) також бере участь у розвитку атеросклеротичного пошкодження тканин. Було виявлено, що, крім свого основного функції-перенесення холестерину, він (але не основна форма ЛПНЩ) знижує активність ферментів, які беруть участь в ексцизійної репарації 8-оксогуаніна. Це ж дослідження показало, що вітамін С спільно з α-токоферолом перешкоджають цьому процесу.
нейродегенеративні захворювання
Можливо оксидативний стрес бере участь в патогенезі хвороби Альцгеймера. Ця теорія ґрунтується на тому, що АФК залучені в нейротоксичность амілоїдного бета- протеїну. Було показано, що пептиди спонтанно генерують вільні радикали. Високий рівень 8-оксогуаніна був виявлений не тільки в лейкоцитах хворих, але і в тканини мозку. Це означає, що зниження репарації ДНК відіграє роль у виникненні хвороби Альцгеймера (у хворих рівень OGG1 (8- оксогуанін-ДНК-глікозілаза) значно нижче, ніж у здорових). Це в якійсь мірі пояснює масову загибель нейронів при цьому важкому захворюванні: накопичення поломок ДНК в пошкоджених нейронах служить сигналом для запуску апоптозу.

Роль оксидативного стресу у виникненні вік-залежних захворювань до цих пір обговорюється. Прихильники "вільнорадикальних теорії старіння" Харман вважають, що накопичення пошкоджень в результаті оксидативного стресу призводить до возрастзавісімих пошкодження тканин, канцерогенезу та, нарешті, до старіння. Але знаходяться і противники цієї теорії. Як би там не було, багато в чому ця теорія вірна, але необхідні дослідження:
1) як саме відбувається пошкодження,
2) як від нього можна захистити клітину і організм в цілому,
3) як активізувати внутрішні резерви,
4) як визначити той ліміт, після якого виникає рак, діабет, атеросклероз і інші супутники старіння?
Ці та багато інших питання належить розкрити вченим, і може бути тоді ми знайдемо еліксир молодості.