Метою даної роботи є:
1. Вивчення методики побудови діаграм по фігуративним точкам;
2. Рішення практичних завдань по діаграмах рівноваги трикомпонентним системам.
До основних завдань звіту відносяться:
1. Побудови основних елементів діаграми.
2. Вивчення загального вигляду діаграми трикомпонентних систем.
¾ основні визначення;
¾ метод нанесення зниження температурних прикордонних кривих;
¾ первинно випадають фази і подальший шлях розпаду кристала;
¾ точку закінчення кристалізації.
Розділ 1 Теоретична частина
Загальний вигляд і елементи діаграми трикомпонентних систем
Діаграма (рисунок 1) являє собою призму, межі якої утворені відповідними двокомпонентними діаграмами і є просторовою фігурою: концентрації компонентів відкладаються на сторонах рівностороннього трикутника (трикутника концентрацій), а температура - на перпендикуляре, проведеному до площини трикутника концентрацій.
На діаграмі трикомпонентної системи замість ліній з'являються поверхні ліквідусу, наприклад: А * -Е1 * -Е * -Е3 * -А *, С * -Е2 - * Е-Е3 * -С *, В * -Е1 * -Е * - Е2 * -У *, при перетині яких утворюються прикордонні криві Е1 * -Е *, Е2 * -Е *, Е3 * -Е *, що сходяться в точці потрійний евтектики Е *.
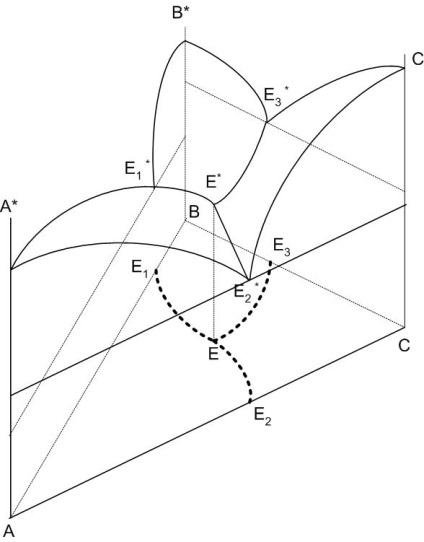
Поверхня ліквідусу має ті ж властивості, що і крива ліквідусу: показує температуру початку кристалізації (кінця плавлення) будь-якого складу системи; склад насиченою рідкої фази знаходиться в рівновазі з твердою фазою при даній температурі.
Малюнок 1 - Просторова діаграма трикомпонентної системи
Прикордонні лінії поділяють трикутник концентрацій на поля первинної кристалізації сполук, що існують в даній системі. Склад кристалів в поле первинної їх кристалізації відзначається гуртком.
Точки складів подвійних сполук перебувають на сторонах трикутника, точки складів потрійних хімічних сполук - всередині його.
Основні поняття діаграми трикомпонентних систем
Проекційну діаграму використовують для зручності роботи, яка утворюються при проектуванні на площину трикутника концентрацій всіх елементів просторової діаграми. Температура на діаграмі показується в цьому випадку изотермами, одержуваними припиненням просторової діаграми площинами, паралельними трикутнику концентрацій при фіксованому значенні температури. Часто ізотерми на проекційної діаграмі не відображаються взагалі, щоб не ускладнювати зображення.
Прикордонні лінії поділяють трикутник концентрацій на поля первинної кристалізації сполук, що існують в даній системі. На малюнку 2 поле Е1 -в- Е2 - Е Е1 - поле первинної кристалізації компонента В, А- Е1 - Е Е3 - А - компонента А і С-Е3 - Е Е2 - С- компонента С.
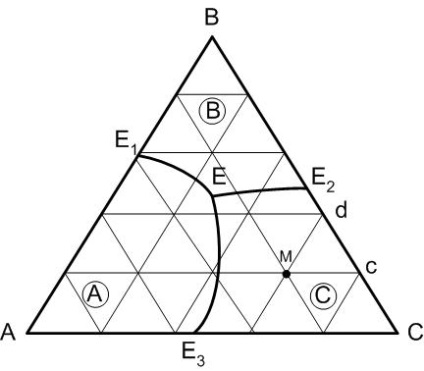
Малюнок 2 - Проекційна діаграма трикомпонентної системи
Точки складів хімічних сполук або компонентів системи, що мають суміжні поля первинної кристалізації, з'єднуються тонкими прямими лініями, що носять назву сполучних прямих. Сполучні прямі розбивають діаграму на окремі, елементарні трикутники, кожен трикутник може розглядатися як окрема діаграма трикомпонентної системи.
Правило важеля в трикомпонентної системі
Для трикомпонентної системи за допомогою правила важеля можна вирішувати такі завдання:
1. Визначення кількісного співвідношення рідкої і твердої фаз при наявності однієї твердої фази.
2. Визначення кількісного співвідношення рідкої і твердої фаз при наявності двох кристалічних фаз з одночасним визначенням кількісного співвідношення кристалічних фаз в складі твердої фази.
3. Визначення співвідношення двох одночасно кристалізуються в даний момент часу фаз.
Основні правила діаграми трикомпонентних систем
Правило 1 - Метод нанесення зниження температурних прикордонних кривих:
Температура завжди знижується від точки перетину прикордонної кривої (або її продовження) з сполучної лінією (або її продовження), що з'єднує точки складів фаз, поля первинної кристалізації яких розділяє дана прикордонна крива. На прикордонній кривої в точці її перетину з сполучної лінією буде знаходитися температурний максимум.
Правило 1 (рисунок 3), дозволяє визначити напрямок зниження температури на прикордонних кривих діаграми - буде визначатися в такий спосіб. На кривій Е1 - Е температура знижується від точки Е1 до точки Е, так як точка Е1 - точка перетину сполучної лінії АВ (що збігається в даному випадку зі стороною проекційної діаграми) і прикордонної кривої Е1 - Е, тобто точка Е1 є точкою температурного максимуму на кривої Е1 - Е.
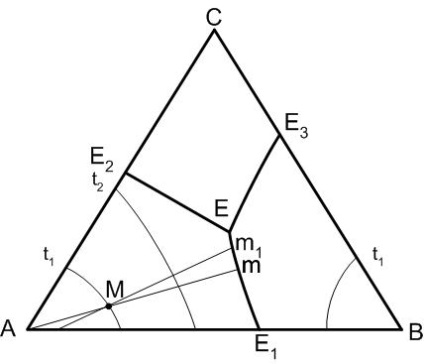
Малюнок 3 - Діаграма стану трикомпонентної системи з точкою потрійний евтектики
Правило 2 - Визначення первинно випадає фази і подальшого шляху розпаду кристала:
1. При кристалізації розплаву, первинно випадає фазою буде тa, в поле первинної кристалізації якої знаходиться точка вихідного складу. Якщо точка вихідного складу належить прикордонної кривої, то первинними фазами будуть тe поля первинної кристалізації, які розділяє дана прикордонна крива.
2. При кристалізації з розплаву однієї твердої фази складу рідкої фази змінюється по продовженню прямої, що проходить в поле кристалізації цієї фази і проведеної через точку складу первинно випадає фази і точку вихідного складу в бік зниження температури.
Після початку кристалізації компонента А (рисунок 3) склад розплаву буде змінюватися по відрізку Mm прямий А-М в сторону точки М. Як тільки склад розплаву дійде до прикордонної кривої Е1-Е розплав стає пересиченим по відношенню до двох твердим фаз: А і В. причому кристали цих фаз будуть одночасно випадати з розплаву (ступінь свободи системи дорівнює одиниці).
Незалежним термодинамічних параметром буде температура, а склад розплаву буде змінюватися при подальшому зниженні температури строго по прикордонної кривої, тобто від точки М по кривій Е1-Е в сторону точки Е. При досягненні температури точки потрійний евтектики tе починається кристалізація компонента С, так як в цьому випадку розплав стає пересиченим по відношенню відразу до трьох компонентів. Нонваріантное стані, характерне для цього випадку, закінчується повною кристалізацією розплаву і подальше можливе охолодження системи призводить до охолодження трьох кристалічних фаз: А, В, С. Таким чином, шлях кристалізації вихідного складу М: М → m → Е. Зміна фазового рівноваги при нагріванні буде зворотним, ніж при охолодженні.
Правило 3 - Визначення точки закінчення кристалізації:
Закінчення кристалізації довільного складу системи відбудеться в точці, де перетинаються поля первинної кристалізації фаз, що знаходяться в вершинах елементарного трикутника, якому належить точка вихідного складу.
З цього правила випливає, що всі склади (дивись малюнок 4), що знаходяться в елементарному трикутнику А-В-АС закінчать свою кристалізацію в точці Е, а кінцевими продуктами кристалізації будуть відповідно кристали компонентів А і В і кристали хімічної сполуки АС.
Якщо початковий склад (точка 3 на діаграмі) розташований на сполучної прямий По-АС, то цей випадок розглядається як діаграма двокомпонентної системи В-АС, для якої точка К є точкою подвійний евтектики і саме там закінчиться кристалізація зазначеного складу.
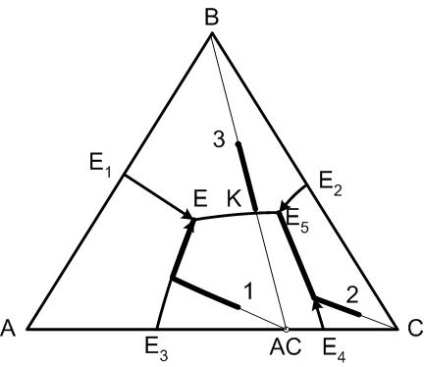
Малюнок 4 - Діаграма трикомпонентної системи з подвійним хімічною сполукою, що плавиться Конгруентність
Правило 4 - Шлях кристалізації точки системи, яка залишала інконгруентную криву і продовжує далі плавиться:
1. Подвійне хімічна сполука в трикомпонентної системі плавиться з розкладанням, якщо точка складу цього з'єднання не належить полю його первинної кристалізації, а останнім примикає до сторони проекційної діаграми, на якій знаходиться склад хімічної сполуки.
2. Шлях кристалізації залишає інконгруентную криву в точці її перетину з продовженням прямої, що з'єднує точку вихідного складу з точкою складу хімічної сполуки. Після цього шлях кристалізації перетинає поле первинної кристалізації хімічної сполуки по продовженню зазначеної вище кривої.
При плавленні з розкладанням хімічна сполука буде виділяти розплав, склад якого визначається проекцією точки перітектікі двухкомпонентной системи на сторону проекційної діаграми, тобто складу U і кристали (в нашому випадку компонента А).
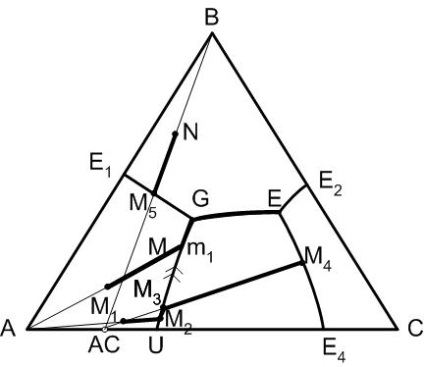
Малюнок 5 - Діаграма трикомпонентної системи з подвійним хімічною сполукою, що плавиться інконгруентно
Точка G на діаграмі носить назву точки подвійного підйому. Це нонваріантная точка діаграми, ознакою якої є те, що за двома відповідним до неї прикордонним кривим температура знижується до точки G і по одній прикордонної кривої температура знижується від точки G. Подальший шлях кристалізації з точки подвійного підйому можливий при зменшенні числа фаз.
Розділ 2 Індивідуальне завдання
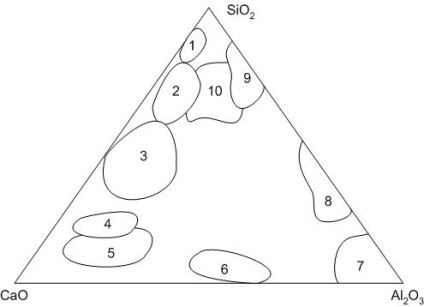
Система СаО-Al2 O3 -SiO2 (рисунок 6) грає важливу роль в теорії та технології виробництва портландцементу, глиноземистого цементу, вогнетривів, скла, тонкої і будівельної кераміки та інших будівельних матеріалів.
Малюнок 6 - Області складів силікатних матеріалів: 1 - динасові вогнетриви; 2 - скла; 3 - кислі шлаки; 4 - основні шлаки; 5 - портландцемент; 6 - глиноземистий цемент; 7 - корундові вогнетриви; 8 - муллітові вогнетриви; 9 - шамотні вогнетриви; 10 - фарфор
У системі є 10 бінарних хімічних сполук і два потрійних з'єднання: алюмосилікати кальцію - природні мінерали анортит і Гелен.