Реактиви: анілін, сірчана кислота конц. гідроксид натрію, соляна кислота конц. активоване вугілля.
Устаткування: порцелянова чашка, стакан на 50 мл, стакан на 100 мл, скляна воронка, воронка Бюхнера, колба Бунзена.
У фарфоровій чашці невеликими порціями змішайте і ретельно розітріть 9,3 г аніліну з 5,5 мл сірчаної кислоти. Отриману сіль нагрівайте на плитці протягом 1-2 годин. Чашка повинна бути розташована на висоті 2-3 см треба плиткою. Тверда маса стає сіро-фіолетовою. Проба її при розчиненні в лугу не повинна виділяти анілін у вигляді крапель.
Ще гарячу сульфаниловую кислоту подрібніть і помістіть в розчин гідроксиду натрію в 36 мл води. Суміш прокип'ятіть 5 хв з активованим вугіллям, відфільтруйте і фільтрат підкислити соляною кислотою (до pH = 3). Випали при охолодженні кристали відфільтруйте і перекрісталлізуйте з води. Продукт висушіть між листами фільтрувального паперу. Вихід 10-12 г (60-70% від теоретичного).
1). В якому вигляді існує сульфанілова кислота у водному розчині?
2). Наведіть приклади сульфируют агентів.
3). Чи є реакція сульфирования оборотної? Якщо так, то як можна змістити рівновагу в бік продуктів реакції?
4). Як виділяють сульфокислоту з реакційної маси?
5). Де застосовують сульфаниловую кислоту і деякі її відомі похідні.
5.2. Синтез п- толуолсульфокіслоти (натрієвої солі)
Реактиви: толуол, сірчана кислота конц. хлорид натрію 30% -ний розчин.
Устаткування: колба круглодонна місткістю 100 мл, зворотний холодильник, колба конічна або стакан ємністю 250 мл, лійка Шотта, колба Бунзена, плитка.
У круглодонную колбу ємністю 100 мл, забезпечену зворотним холодильником, помістіть 14,7 мл толуолу і 8,7 мл конц. H2 SO4. Суміш нагрійте до слабкого і рівномірного кипіння. Слабке кипіння толуолу підтримуйте протягом години, добре перемішуючи суміш, для чого колбу обережно струшуйте кожні 1-2 хвилини.
Приблизно через годину, коли шар толуолу майже зникне, нагрівання припиніть і вилийте теплу реакційну суміш в колбу, в якій міститься 40 мл води. Розчин упарьте на плитці із закритою спіраллю при слабкому нагріванні до 20 мл. Кип'ятіння проводите під тягою, так як при цьому одночасно з парою отгоняются сліди толуолу.
Потім реакційну суміш охолодіть льодом до 5-7 ° С і приплив до неї 20 мл насиченого розчину хлориду натрію. Через деякий час (15-20 хв) випала натрієву сіль п - толуолсульфокіслоти отфильтруйте на воронці Шотта, ретельно відіжміть від маточного розчину і висушіть.
При необхідності продукт перекрісталлізовивают з 10% -ного розчину хлориду натрію.
1). При сульфірованіі толуолу сірчаною кислотою при 0 ° С утворюється 42% о- толуолсульфокіслоти і 54% п-ізомери. При 100 ° С утворюється 13% о- ізомери і 79% п-ізомери. Поясніть ці результати.
2). Розмістіть наведені нижче сполуки в порядку зменшення їх активності по відношенню до сульфируют агенту (SO3 H +): толуол, етилбензол, бромбензол, нітробензол, анізол, нафталін. Які продукти реакції утворюються в результаті моносульфірованія?
3). Які моносульфокіслоти можуть бути отримані при сульфірованіі аніліну, N, N-диметиланилина, хлорбензолу, бензальдегида.?
4). Напишіть структурні формули наступних сполук:
е) м-сульфобензойная кислота.
6. СИНТЕЗ галогеналкіли НА ОСНОВІ СПИРТІВ
Реактиви: етиловий спирт, бромід калію, сірчана кислота конц. хлористий кальцій (гранулюван. безв.).
Устаткування: колба круглодонна, конічна колба з притертою кришкою, холодильник, термометр, дефлегматор, делительная воронка, мірний циліндр, скляні стакани на 50 мл, плитка.
У колбу (1) помістіть 7 г спирту, додайте 6 мл дистильованої води і при постійному перемішуванні і охолодженні прилейте 12,5 мл сірчаної кислоти. Суміш остудіть і при перемішуванні додайте 10 г тонко розтертого броміду калію. Колбу з'єднайте з дефлегматором (2) і холодильником (3). До холодильника приєднаєте аллонж (4). У дефлегматоре відбувається часткова конденсація менш летючих компонентів і тому деякий збагачення парів, які перетворюються в дистилят, більш летючим компонентом. У колбу-приймач (5) налийте трохи води з декількома шматочками льоду і занурте в крижану воду аллонж (для зменшення втрат продукту реакції, тому що галогеналкани летючий).
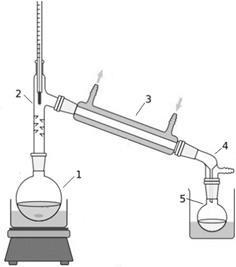
Мал. 5. Прилад для отримання брометан.
Реакційну суміш нагрівайте на піщаній бані до тих пір, поки в приймачі не перестануть з'являтися маслянисті краплі, опускаються на дно. Якщо реакційна суміш в колбі сильно піниться, на час припиніть нагрівання.
Після закінчення реакції відокремте в ділильної воронці брометан в колбу, додайте кілька кульок хлориду кальцію. Через 40-60 хв брометан стає прозорим і його відокремлюють і вимірюють обсяг. Визначте показник заломлення отриманого продукту, порівняйте з табличним значенням.
Реактиви: н-бутиловий спирт, бромистий калій, сірчана кислота конц. бисульфит натрію, бікарбонат натрію, хлористий кальцій (гранулюван. безв.).
Устаткування: колба круглодонна, конічна колба з притертою кришкою, холодильник, термометр, делительная воронка, мірний циліндр, скляні стакани на 50 мл, плитка.
У круглодонную колбу прилейте 23 мл дистильованої води і додайте 25 г тонко розтертого бромистого калію і 15 мл бутилового спирту. Приєднайте зворотний холодильник, вставте в його внутрішню трубку воронку і через неї невеликими порціями прильоту 17 мл концентрованої сірчаної кислоти, кожен раз добре перемішуючи суміш погойдуванням колби (зажим, що утримує холодильник, повинен бути затиснутий нещільно).
У колбу киньте кілька порцелянових осколків і нагрійте до кипіння на плитці, не допускаючи дотику колби до її нагрівальної поверхні. Після 2 годинного кипіння реакційної суміші замініть зворотний холодильник на низхідний і, посиливши нагрівання, швидко відженете бутілбромід. Сирий продукт містить домішки води, бутилового спирту, дибутиловий ефіру, трохи бутилену і сліди брому.
Продукт промийте в ділильної воронці водою, що містить трохи бисульфита; відокремивши водний шар, перелийте бутілбромід в суху ділильну лійку і для видалення ефіру промийте рівним об'ємом холодної концентрованої сірчаної кислоти. Кислоту відокремте, промийте знову бутілбромід послідовно дистильованою водою, розбавленим розчином бікарбонату натрію і знову водою і висушіть хлористим кальцієм. Отриманий продукт переженете, збираючи фракцію, киплячу в межах 98-103 ° С. Температура кипіння чистого речовини 101,6 ° С.
1). Наведіть механізми реакцій SN 1 і SN 2. До якого з механізмів можна віднести ваш синтез?
2). Які розчинники сприяють реакцій SN 1, а які SN 2?
3). Яку іменну якісну реакцію проводять для виявлення в пробі галогеналкани? Наведіть реакцію.
4). Чому продукт забарвлений в жовтий колір?
5). Області застосування галогеналканов.
7. реакції гідролізу І ЕФЕРІФІКАЦІІ