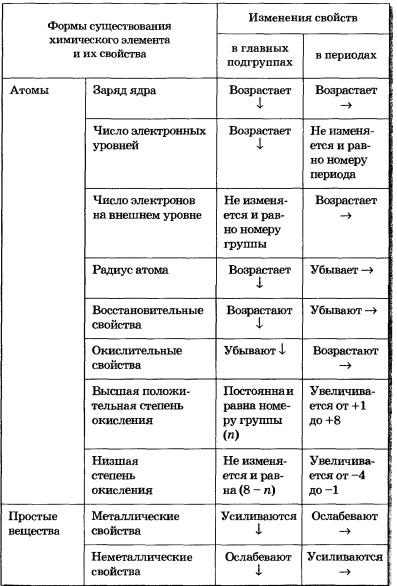
Модель будови атома
Наукові дослідження, що проводилися в кінці XIX - початку XX ст. дозволили запропонувати наступну модель будови атома:
- У центрі атома знаходиться позитивно заряджене ядро, що займає незначну частину простору всередині атома.
- Весь позитивний заряд і майже вся маса атома зосереджені в його ядрі.
- Ядра атомів складаються з протонів і нейтронів (нуклонів). Число протонів в ядрі дорівнює порядковому номеру елемента, а сума чисел протонів і нейтронів відповідає його масового числа.
- Навколо ядра по замкнутих орбітах обертаються електрони. Їх число дорівнює позитивному заряду ядра.
Ядро - це центральна позитивно заряджена частина атома, у якій зосереджена його маса.
Електрон - частинка з негативним зарядом, який умовно прийнятий за -1.
Нейтрон- нейтральна частинка, яка не має електричного заряду. Маса нейтрона дорівнює 1 а. е. м.
Протон- позитивно заряджена частинка, з такою ж масою, як і нейтрон. Заряд протона дорівнює заряду електрона і протилежний за знаком.
Число протонів в ядрі атома дорівнює числу електронів. Це число визначає заряд ядра атома елемента і його порядковий номер елемента в таблиці Менделєєва.
При відомих умовах нейтрон може перетворюватися в протон і навпаки.
Атомні маси елементів в періодичній таблиці є середнім значенням з масових чисел природних сумішей з ізотопів. Тому вони не можуть, як вважав Менделєєв, служити головною характеристикою атома і елемента. Такий характеристикою є заряд ядра атома. Він визначає число електронів в нейтральному атомі, які розподіляються навколо ядра по певних орбітах і визначають хімічні властивості атомів. В результаті цього було дано нове визначення хімічного елемента і уточнено формулювання періодичного закону:
Хімічний елемент-це сукупність атомів з однаковим зарядом ядра.
Властивості елементів, а також властивості та форми їх сполук перебувають у періодичній залежності від заряду ядра атома елемента.
Відкрите Беккерелем явище радіоактивності було першим прикладом ядерних реакцій- перетворень ядер одного елементу в ядра інших елементів. Зараз відомо дуже багато ядерних реакцій; всі вони відносяться до фізичних явищ і тому в звичайному курсі хімії не розглядаються.
Основні положення періодичного закону Д. І. Менделєєва
За основу класифікації хімічних елементів Менделєєв прийняв масу атомів елементів. Маючи в своєму розпорядженні відомі на той час елементи в порядку зростання їх атомних ваг, Менделєєв виявив, що властивості елементів періодично повторюються. У 1869 р Менделєєв відкрив періодичний закон і в 1871 р так його сформулював: "Фізичні і хімічні властивості елементів, які проявляються у властивостях простих і складних тіл, ними утворених, стоять у періодичній залежності від їх атомної ваги".
Зараз основною характеристикою, що визначає приналежність атома до того чи іншого елементу, є заряд ядра атома, який відповідає порядковому номеру елемента в періодичній системі. Тому сучасне формулювання періодичного закону така: властивості простих речовин, а також форми і властивості з'єднань хімічних елементів знаходяться в періодичній залежності від заряду ядер атомів елементів або від порядкового номера елементів.
Наприклад, в ряду від літію до неону в міру зростання зарядів ядер властивості елементів змінюються в цілком певному напрямку. Валентність по кисню від літію до азоту у кожного наступного елемента збільшується на одиницю, а валентність за воднем від вуглецю до фтору, навпаки, зменшується на одиницю. Металеві властивості від літію до фтору поступово слабшають, а неметалічні - посилюються.
В ряду від натрію до аргону властивості елементів в значній мірі повторюють властивості елементів від літію до неону. Причому повторення проявляється в певній послідовності: натрій повторює властивості літію, магній - берилію, алюміній - бору і так далі. Наступний за аргоном калій повторює властивості натрію і літію, кальцій - магнію і берилію, інакше кажучи, властивості елементів періодичної системи повторюються. Цю періодичність не можна розглядати як просте повторення властивостей. Однак властивості елементів повторюються в різного ступеня.
Всю сукупність елементів можна представити у вигляді єдиної природної системи - періодичної системи хімічних елементів.
У періодичної системі всі елементи складають 7 періодів. Перший період включає 2 елементи - водень і гелій. З калію до криптону і з рубідію до ксенону четвертий і п'ятий періоди включають в себе вже 18 елементів. Шостий період містить 32 елемента. Сьомий період не закінчений. Періодичність в повторенні властивостей хімічних елементів різна. Три перших періоду називаються малими, решта - великими.
Якщо в малих періодах зі збільшенням порядкового номера все хімічні властивості елементів змінюються послідовно, то в великих періодах деякі властивості елементів повторюються всередині періоду ..
Періодичну систему хімічних елементів можна відобразити в формі таблиці. Було створено безліч різних варіантів таблиць. Однак найбільш наочними, а значить, найбільш часто використовуваними є розгорнута і скорочена форми таблиці.


Розгорнуту форму таблиці отримують, коли послідовні періоди елементів розмістити у вигляді горизонтальних рядів, так щоб подібні за властивостями елементи виявилися строго один під одним. У такій таблиці короткі періоди виявляються розділеними - по 2 елементи на початку і по 6 в кінці таблиці, а між ними в четвертому і п'ятому періодах по 10 елементів, в шостому - 32 елемента (14 лантаноїдів разом з лантаном розміщуються в одній клітці); всього 10 стовпців. Елементи з подібними властивостями в вертикальних шпальтах цієї таблиці утворюють підгрупи. Підгрупи з елементами другого і третього коротких періодів називаються головними, а решта - побічними. Всього в таблиці 8 головних і 8 побічних підгруп: всього 16. Головні підгрупи позначаються індексом "а" - Іа, IIа. Побічні підгрупи позначаються індексом "б" - Іб, IIб і т. Д.
У підгрупу ІІІб входять по 14 елементів сімейства лантаноїдів і актиноїдів, винесені у вигляді окремих рядків за межі основної таблиці. Це відбувається тому, що елементи цих родин мають велику схожість хімічних властивостей і розміщуються в одній клітці основної таблиці.
У скороченій формі таблиці періодичної системи головні і побічні підгрупи суміщені в одну групу, але зрушені по горизонталі таким чином, що елементи головних і побічних підгруп утворюють окремі стовпці. Великі періоди в скороченій формі таблиці утворюють два ряди. Найчастіше використовується саме скорочена форма таблиці, в силу її компактності і зручності використання.
Також існує безліч інших форм періодичної системи:
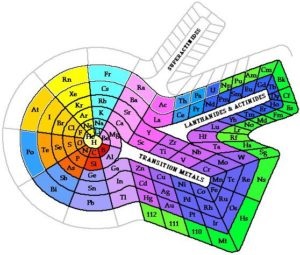
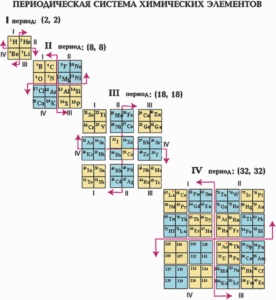
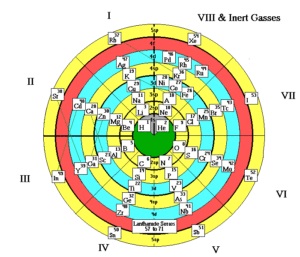
Будова атома і періодичний закон
Вивчення будови атомів і хімічних властивостей відповідних елементів з характером розподілу електронів по енергетичним рівням в атомах показало, що хімічні властивості елементів визначаються в основному будовою зовнішньої електронної оболонки.
Так як періодичність в зміні хімічних властивостей елементів неоднакова, т. Е. Періодична система включає в себе один період з 2 елементів, два по 8, два по 18 і один 32 елемента. Останній, сьомий, період незакінчений і містить 19 елементів. Така періодичність пов'язана з закономірностями заповнення електронами енергетичних рівнів атома (принцип Паулі, правило Гунда, правило Клечковского):
З наведеного ряду випливають два правила: на зовнішньому енергетичному рівні будь-якого атома не може бути більше 8 електронів і на предвнешнего енергетичному рівні будь-якого атома не може бути більше 18 електронів. Так як будь-який зовнішній рівень не може бути більше ніж 8 електронів, зовнішні оболонки з 8 електронами називаються завершеними. Вони характерні лише для атомів благородних газів і є дуже стійкими.
Залежно від орбіталі, які заповнюються електронами при формуванні електронних оболонок, розрізняють s-, p-, d- і f- елементи.
Знаючи послідовність заповнення електронами атомних орбіталей, можна зрозуміти особливості періодичної системи хімічних елементів. Оскільки кожен період починається з формування нової електронної оболонки, то число електронних оболонок у атома дорівнює номеру періоду, в якому знаходиться атом. s - і р-елементи складають головні підгрупи таблиці періодичної системи, d- і f-елементи - побічні.
Характер зміни властивостей елементів у періодах і групах
У елементів головних підгруп (це s- і р-елементи) кількість електронів на зовнішній оболонці дорівнює номеру групи.
У всіх d-елементів на зовнішній електронній оболонці знаходяться тільки два електрони, так як у них заповнюються d-орбіталі предвнешнего шару. Тому вони й називаються d-елементами. Характер зміни властивостей в періоді у цих елементів буде визначатися насамперед зміною стану предвнешнего електронної оболонки. Тому у d-елементів в періоді властивості змінюються не так різко, як у s- або р-елементів, все
d-елементи є металами.
У f-елементів заповнюються в основному f-орбіталі, які закриті восьміелектронной предвнешнего і двухелектронной зовнішньої оболонками. Тому вплив електронної конфігурації f-оболонки на властивостях практично не відбивається, і f-елементи настільки схожі, що їх поміщають в одну клітку таблиці.