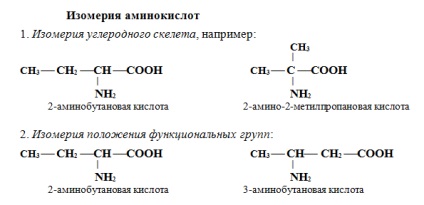
За систематичною номенклатурою назви амінокислот утворюються з назв відповідних кислот додатком приставки аміно і зазначенням місця розташування аміногрупи по відношенню до карбоксильної групи.
Часто використовується також інший спосіб побудови назв амінокислот, згідно з яким до тривіального назвою карбонової кислоти додається приставка аміно із зазначенням положення аміногрупи буквою грецького алфавіту. приклад:
Для a-амінокислот, які грають виключно важливу роль в процесах життєдіяльності тварин і рослин, застосовуються тривіальні назви.
Якщо в молекулі амінокислоти міститься дві аміногрупи, то в її назві використовується приставка діаміно. три групи NH2 - тріаміно і т.д.
Наявність двох або трьох карбоксильних груп відбивається в назві суфіксом -діовая або -тріовая кислота:
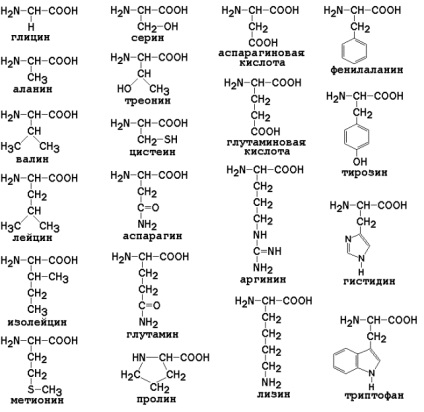
Все a-амінокислоти, крім гліцину H2 N-CH2 -COOH, містять асиметричний атом вуглецю (a-атом) і можуть існувати у вигляді дзеркальних антиподів.
Оптична ізомерія природних a-амінокислот відіграє важливу роль в процесах біосинтезу білка.
Фізичні властивості. Амінокислоти - тверді кристалічні речовини з високою т.пл. при плавленні розкладаються. Добре розчинні у воді, водні розчини електропровідні. Ці властивості пояснюються тим, що молекули амінокислот існують у вигляді внутрішніх солей, які утворюються за рахунок перенесення протона від карбоксилу до аминогруппе
Амінокислоти проявляють властивості основ за рахунок аміногрупи і властивості кислот за рахунок карбоксильної групи, т.е.являются амфотерними сполуками. Подібно амінів, вони реагують з кислотами з утворенням солей амонію:
Як карбонові кислоти вони утворюють функціональні похідні:
б) складні ефіри
Крім того, можлива взаємодія аміно- і карбоксильної груп як усередині однієї молекули (внутримолекулярная реакція для g-, d- e- і т.д. амінокислот), так і належать різним молекулам (межмолекулярная реакція).
Практичне значення має внутримолекулярное взаємодія функціональних груп e-амінокапронової кислоти, в результаті якого утворюється e-капролактам - напівпродукт для отримання капрону.
Міжмолекулярної взаємодії a-амінокислот призводить до утворення пептидів. При взаємодії двох a-амінокислот утворюється дипептид Міжмолекулярна взаємодія трьох a-амінокислот призводить до утворення трипептида і т.д.
Фрагменти молекул амінокислот, що утворюють пептидних ланцюг, називаються амінокислотними залишками, а зв'язок CO-NH - пептидним зв'язком.
