живильні середовища
Вимоги, що пред'являються до середах
- бути поживними, тобто містити в легко засвоюваному вигляді все речовини, необхідні для задоволення харчових і енергетичних потреб. При культивуванні ряду мікроорганізмів в середовища вносять фактори росту - вітаміни, деякі амінокислоти, які клітина не може синтезувати.
- мати оптимальну концентрацію водневих іонів - pH, тому що тільки при оптимальній реакції середовища, що впливає на проникність оболонки, мікроорганізми можуть засвоювати живильні речовини.
Для більшості патогенних бактерій оптимальна слаболужна середу (pH 7,2-7,4). Виняток становлять холерний вібріон - його оптимум знаходиться в лужному зоні (pH 8,5-9,0) і збудник туберкульозу, що потребує слабокислою реакції (pH 6,2-6,8).
Щоб під час росту мікроорганізмів кислі або лужні продукти їх життєдіяльності не змінили pH, середовища повинні володіти буферностью. тобто містити речовини, що нейтралізують продукти обміну.
- бути Ізотонічність для мікробної клітини; тобто осмотичний тиск в середовищі повинно бути таким же, як всередині клітини. Для більшості мікроорганізмів оптимальне середовище, відповідна 0,5% розчину натрію хлориду.
- бути стерильними, тому що сторонні мікроби перешкоджають росту досліджуваного мікроба, визначенню його властивостей і змінюють властивості середовища.
- щільні середовища повинні бути вологими і мати оптимальну для мікроорганізмів консистенцію.
- володіти певним окисно - відновним потенціалом, тобто співвідношенням речовин, які віддають і приймають електрони, що виражається індексом RH2. Наприклад, анаероби розмножуються при RH2. не вище 5, а аероби - при RH2 не нижче 10.
- бути по можливості уніфікованим, тобто містити постійне кількість окремих інгредієнтів.
Бажано, щоб середовища були прозорими - зручніше стежити за ростом культур, легше помітити забруднення середовища сторонніми мікроорганізмами.

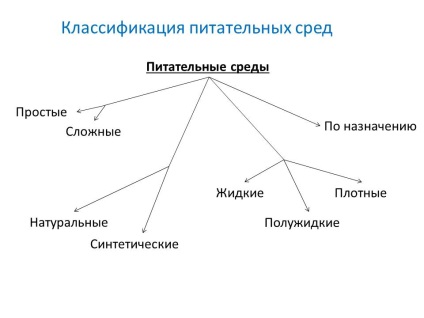
- За вихідними компонентами:
- натуральні середовища - готують з продуктів тваринного і рослинного походження (м'ясо, кісткове і рибне борошно, кормові дріжджі, згустки крові і ін.)
- синтетичні середовища - готують з певних хімічно чистих органічних і неорганічних сполук, взятих в точно зазначених концентраціях і розчинених в двічі дистильованої води.
- За консистенцією (ступеня щільності):
- рідкі
- напіврідкі
- щільні
Щільні і напіврідкі середовища готують з рідких, до яких додають агар-агар або желатин. Крім того, в якості щільних середовищ застосовують згорнуту сироватку крові, згорнуті яйця, картопля, середовища з селікагелем.Некоторие мікроорганізми використовують желатин як поживна речовина - при їх зростання серед розріджується.
- За складом:
- прості: мясопептонний бульйон (МПБ), мясопептонний агар (МПА). живильний желатин,
- складні - готують додаючи до простих середах кров, сироватку, вуглеводи та інші речовини.
- За призначенням:
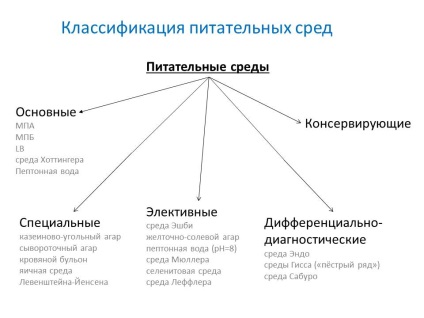
- основні - служать для культивування більшості патогенних мікробів. МПБ, МПА, бульйон і агар Хоттингера, пептонна вода.
- спеціальні - служать для виділення і вирощування мікроорганізмів, які не ростуть на простих середовищах.
- елективні (виборчі) - служать для виділення певного виду мікробів, зростання яких вони сприяють, затримуючи або пригнічуючи зростання супутніх мікроорганізмів. Середовища стають елективних при додаванні до них певних антибіотиків, солей, зміни pH. Рідкі елективні середовища називають середовищами накопичення.
- диференційно-діагностичні - дозволяють відрізнити один вид мікробів від іншого по ферментативної активності.
- консервуючі - призначені для первинного посіву та транспортування досліджуваного матеріалу.
- м'ясо-пептони бульйон (МПБ) - рідке середовище
- м'ясо-пептони агар (МПА) - щільне середовище
спеціальні
Спеціальні методи характеризуються додаванням специфічного компонента або заміною основи.
- казеїново-вугільний агар
- сироватковий агар
- кров'яної бульйон
- яєчного середовища Левенштейна-Йенсена
Електівниє
Електівниє методи характеризуються отриманням зростання тільки цікавить мікроорганізму.
- Середа Ешбі - для азотфиксаторов
- желточно-сольовий агар (ЖСА) - для стафілокока
- пептонна вода (1%, pH = 8) - для холерного вібріона
- середовища Мюллер - для сальмонел
- селенітовий п'ятниця - для сальмонел
- Середа Леффлера - ефективна для коринебактерій дифтерії
Диференційно-діагностичні
Дозволяють зробити ідентифікацію окремих типів, видів і груп бактерій.
- середовища Гіссен ( «строкатий ряд»)
- Середовище Ендо - визначення вірулентних ентеробактерій
- середовище Сабуро - з додаванням антибіотика
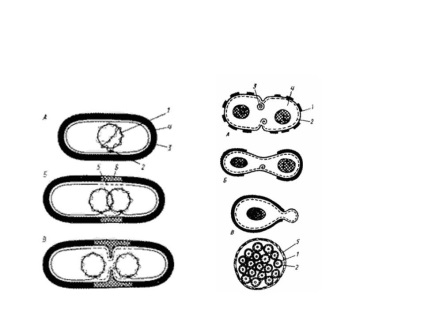

синхронні культури
Синхронні культури - це бактеріальні культури або популяції, в якій всі клітини знаходяться на однаковій стадії клітинного циклу. У природних культурах - періодичних і проточних - такого явища не спостерігається. Навіть в експоненційної фазі росту в культурі містяться неделящиеся і знаходяться на різних стадіях поділу клітини. Синхронне поділ клітин викликають штучно, впливаючи на культуру багатьох факторів, наприклад, зниженою або підвищеною температурою. Вважається, що несприятливі температури більше позначаються на розвитку клітин, які діляться, більш чутливих до дії різних факторів. В результаті відбувається гальмування розвитку. За цей час до поділу підготуються інші клітини культури. Наступне за ним вплив оптимальної температури поступово викликає синхронне ділення клітин. Для отримання синхронних культур використовують метод вимушеного голодування. Клітини поміщають на неповноцінну середу, культивують, потім переносять на повноцінну. У фотосинтезуючих бактерій синхронні культури отримують чергуванням світлових і темнових режимів культивування. Також використовують механічні методи: пропускання культури через спеціальні фільтри (відбір клітин однакового розміру) і центрифугування (клітини, що знаходяться на початку циклу поділу, більш дрібні і осідають повільніше).
Синхронні культури використовують для вивчення синтезу окремих клітинних компонентів в процесі поділу клітини.
безперервні культури
У 50-і роки 20 століття був розроблений метод безперервного культивування мікроорганізмів (метод проточних культур). Суть методу полягає в тому, що в культиватор, де проводиться вирощування бактерій, весь час надходить свіжа живильне середовище і одночасно з такою ж швидкістю виводиться культуральна рідина. В результаті для мікроорганізмів створюються незмінні умови щодо наявності поживних речовин і фактично відсутність продуктів обміну. Регулюючи швидкість проточною середовища, можна управляти розвитком бактеріальної популяції, наприклад, затримати культуру в логарифмічній фазі росту на будь-який тривалий час.
Безперервне культивування здійснюється в спеціальних приладах - Хемостат і турбідостатах. У Хемостат зростання культури контролюється концентрацією субстрату. Підтримуючи постійної концентрацію одного з необхідних субстратів (джерело азоту або вуглецю) шляхом регулювання швидкості протоки середовища, можна стабілізувати швидкість росту культури і щільність популяції. При великих швидкостях протоку середовища зростання культури більш інтенсивний і наближається до максимального; при менших - більш повільний внаслідок обмеженого надходження субстрату. Однак збільшення швидкості протоки з метою усунення обмеження зростання культури субстратом призводить до вимивання культури, зниження щільності популяції.
На відміну від Хемостат принцип роботи турбідостата заснований на регулюванні швидкості протоки середовища щільністю популяції. У турбідостате щільність популяції контролюється за допомогою фотоелемента, з'єднаного з реле, яке регулює подачу середовища. Як тільки щільність популяції досягне заданого рівня, реле спрацьовує і в культиватор починає надходити свіжа середу. В результаті концентрація клітин зменшується до певного рівня, після чого автоматично відключається подача середовища. У турбідостате досягається максимальна швидкість росту культури при більшій щільності популяції і більшої точності регулювання надходження середовища.
Проточне культивування мікроорганізмів використовується у вивченні фізіології мікроорганізмів, тому що дозволяє їх культивувати в контрольованих умовах. Крім того, цей метод знайшов широке застосування в мікробіологічної промисловості, тому що дає можливість управляти біосинтетичних процесів мікроорганізмів.

Виділення чистих культур мікроорганізмів
Чистої культурою називають таку культуру, яка містить мікроорганізми одного виду. Виділення чистих культур бактерій - обов'язковий етап бактеріологічного дослідження в лабораторній діагностиці інфекційних хвороб, у вивченні мікробної забрудненості різних об'єктів навколишнього середовища, і, в цілому, при будь-якій роботі з мікроорганізмами. Досліджуваний матеріал (гній, мокротиння, фекалії, кров і інший матеріал від хворих; вода, грунт, повітря, харчові продукти, трупи тварин і людини, переносники) зазвичай містить асоціації мікробів.
Виділення чистої культури дозволяє вивчити морфологічні, культуральні. біохімічні, антигенні та інші ознаки, за сукупністю яких визначається видова і типова приналежність збудника, тобто проводиться його ідентифікація.
Для виділення чистих культур мікроорганізмів використовують методи, які можна розділити на кілька груп.
- Метод Пастера - послідовне розведення досліджуваного матеріалу в рідкому поживному середовищі до концентрації однієї клітини в обсязі (має історичне значення).
- Метод Коха ( «пластинчасті розводки») - послідовне розведення досліджуваного матеріалу в розплавленому агарі (температура 48-50 ° С), з подальшим розливом в чашки Петрі, де агар застигає. Висіву роблять, як правило, з трьох-чотирьох останніх розведень, де бактерій стає мало і, в подальшому, при зростанні на чашках Петрі з'являються ізольовані колонії, які утворюються з однієї вихідної материнської клітини. З ізольованих колоній в глибині агару отримують чисту культуру бактерій пересівом на свіжі середовища.
- Метод Шукевича - застосовується для отримання чистої культури протея та інших мікроорганізмів володіють «повзучим» ростом. Посів досліджуваного матеріалу виробляють в конденсаційну воду біля основи скошеного агару. Рухливі мікроби (протей) здатні підніматися вгору по скошеного агару. нерухомі форми залишаються рости внизу на місці посіву. Пересіваючи верхні краї культури можна отримати чисту культуру.
- Метод Дрігальского - широко застосовується в бактеріологічній практиці, при цьому досліджуваний матеріал розводять в пробірці стерильним фізіологічним розчином або бульйоном. Одну краплю матеріалу вносять в першу чашку і стерильним скляним шпателем розподіляють по поверхні середовища. Потім цим же шпателем (НЕ пропалюючи його в полум'я пальника) роблять такий же посів у другій і третій чашках. З кожним посівом бактерій на шпателі залишається все менше і менше і, при посіві на третю чашку, бактерії будуть розподілятися по поверхні живильного середовища окремо один від одного. Через 1-7 доби витримування чашок в термостаті (в залежності від швидкості росту мікроорганізмів) на третій чашці кожна бактерія дає клон клітин, утворюючи ізольовану колонію, яку пересівають на скошений агар з метою накопичення чистої культури.
- Метод Вейнберга. Особливі труднощі виникають при виділенні чистих культур облігатних анаеробів. Якщо контакт з молекулярним киснем не викликає відразу ж загибелі клітин, то посів роблять за методом Дрігальского. але після цього чашки відразу поміщають в анаеростатах. Однак частіше користуються методом розведення. Сутність його полягає в тому, що розведення досліджуваного матеріалу проводять в розплавленої та охолодженої до 45-50 ° С агарізірованной живильному середовищі. Роблять 6-10 послідовних розведень, потім середу в пробірках швидко охолоджують і заливають поверхню шаром суміші парафіну і вазелінового масла, щоб перешкодити проникненню повітря в товщу живильного середовища. Іноді живильне середовище після посіву і перемішування переносять в стерильні трубки Бурри або капілярні піпетки Пастера, кінці яких запаюють. При вдалому розведенні в пробірках, трубках Бурри. піпетках Пастера виростають ізольовані колонії анаеробів. Щоб ізольовані колонії добре було видно, використовують прояснені поживні середовища. Для вилучення ізольованих колоній анаеробів, пробірку злегка нагрівають, обертаючи її над полум'ям, при цьому агар. прилеглий до стінок, плавиться і вміст пробірки у вигляді агарного стовпчика вислизає в стерильну чашку Петрі. Стовпчик агару розрізають стерильним пінцетом і витягають колонії петлею. Витягнуті колонії поміщають в рідку середу, сприятливу для розвитку виділяються мікроорганізмів (наприклад, середу Кітт-Тароцці). Агарізірованную середу з трубки Бурри видувають, пропускаючи газ через ватяну пробку.
- Метод Хангейта - коли хочуть отримати ізольовані колонії бактерій з особливо високою чутливістю до кисню (ст рогіе аероби) використовують метод обертових пробірок Хангейта. Для цього розплавлену агарізірованную середу засівають бактеріями при постійному струмі через пробірку інертного газу, звільненого від домішки кисню. Потім пробірку закривають гумовою пробкою і поміщають горизонтально в затиск, що обертає пробірку, середа при цьому рівномірно розподіляється по стінках пробірки і застигає тонким шаром. Застосування тонкого шару в пробірці, заповненої газовою сумішшю, дозволяє отримати ізольовані колонії, що абсолютно очевидно неозброєним оком.
- Виділення окремих клітин за допомогою мікроманіпулятора. Мікроманіпулятор - прилад, що дозволяє за допомогою спеціальної микропипетки або мікропетлі витягувати одну клітку з суспензії. Цю операцію контролюють під мікроскопом. На предметному столику мікроскопа встановлюють вологу камеру, в яку поміщають препарат «висяча крапля». У власниках операційних штативів закріплюють микропипетки (мікропетлі), переміщення яких в поле зору мікроскопа здійснюється з мікронною точністю завдяки системі гвинтів і важелів. Дослідник, дивлячись в мікроскоп, витягує окремі клітини мікропіпетку і переносить їх в пробірки зі стерильною рідкої середовищем для отримання клону клітин.