Велика частина статей на сайті присвячена поясненню того, яким чином білки переносяться через мембрану ЕПР (ЕПР). В основному це пов'язано з тим, що транспортна функція ЕПР вивчена найкраще. Досить докладно досліджено основний шлях транслокации секреторних білків. Однак питання, пов'язані з транслокацией більш складних субстратів, залишаються недослідженими, особливо це стосується інтеграції мембранних білків.
Яким чином орієнтуються трансмембранні домени і що визначає їх інтеграцію в мембрану? Яку роль відіграє взаємодія між ТМ доменами, яке відбувається до моменту їх інтеграції? Поряд з цим, стає ясно, що транслокація є регульований процес, при якому ефективність позиціонування, перенесення і інтеграції білка, а також необхідні для цього фактори, які суттєво залежать від субстрату і від умов, в яких знаходиться клітина. Поки ми не розуміємо, як регулюється транслокация і яким чином клітина здійснює цей процес відповідно до своїх потреб.
Хоча в даний час з'ясовано структура каналу транслокации, спосіб мобілізації та ворітної механізм транслокона ще досліджуються. Яким чином впізнавання сигнальної послідовності призводить до структурних змін каналу? Чи володіє структура каналу гнучкістю, достатньої для переорієнтації яку переносять ланцюга, або для забезпечення накопичення декількох трансмембранних доменів? Що відбувається зі структурою каналу після закінчення транслокации? В який час і яким чином білки, що знаходяться поблизу від транслокона, зв'язуються з ним?
Ще менш вивчено питання, як ЕПР здійснює згортання білків, а також дізнається і видаляє білки з неправильною структурою. Майже зовсім не досліджений найбільш фундаментальний аспект процесу, яким чином органел-ла «відчуває» правильно і неправильно зібраний білок Багато належить з'ясувати про те, як шаперони взаємодіють з білками. Необхідно визначити, наскільки тісно взаємодіють між собою численні системи шаперонов ЕПР і чи мають вони різними або перекриваються функціями. Також залишається незрозумілим, яким чином клітина приймає рішення про деградацію білка, що володіє неправильною структурою.
Існування механізму, який би тривалість його взаємодії з шаперонами, представляється привабливим. проте будь-які припущення про те, яким чином він може працювати, відсутні. Нарешті, невідомо, як білок, відібраний для деградації, прямує назад в канал і в цитозоль. Це ж відноситься до механізму, за допомогою якого канал може відкриватися зсередини.
Нарешті, невідомі механізми. керуючі динамікою ЕПР в цілому. Яким чином органела зберігає свою характерну форму? Як підтримуються субкомпартменти? Як здійснюється зв'язок ЕПР з цитоскелетом і як він переміщається в клітці? Чим визначаються розміри ЕПР і яким чином він розширюється? Існування відгуку неструктурованих білків свідчить про взаємозв'язок між ЕПР і ядром. Можливо, що наявність такого взаємозв'язку допоможе відповісти на деякі з перерахованих особливостей ЕПР. Наявність контактів між ЕПР і іншими компартментами клітини дозволяє припускати, що між ними можливий обмін, проте, яким конкретним чином це може відбуватися, залишається невідомим.
У клітці міститься багато різних органел. оточених мембранами, деякі з яких імпортують білки прямо з цитозолю. Мітохондрії, хлоропласта і пероксисоми імпортують необхідні білки. Ендоплазматичнийретикулум (ЕПР) також імпортує білки з цитозолю, проте більшість цих білків транспортується далі, або секретується, або функціонує в органел ах і мембранах, які не можуть імпортувати білки самі. До їх числа відносяться плазматична мембрана і органели секреторного або ендоцітозного шляху.
Білки, що імпортуються в органели. ідентифікуються за допомогою сигнальної послідовності, що представляє собою коротку ланцюжок амінокислот, звичайно розташовану на N-кінці ланцюга. Послідовності, що відповідають різним органел, розрізняються по довжині і за складом. Послідовності ЕПР містять близько двадцяти амінокислот і характеризуються протяжним ділянкою, що складається з гідрофобних залишків. Близькими розмірами мають сигнальні послідовності мітохондрій. Однак вони містять чергуються групи гідрофобних і заряджених амінокислот. Тому, коли сигнальна послідовність приймає форму а спіралі, одна її сторона стає гідрофобною, а інша зарядженої.
Сигнальна послідовність пероксисом зазвичай складається тільки з трьох амінокислотних залишків. У всіх випадках білки ідентифікуються і позиціонуються більше не у відповідності зі складом сигнальних послідовностей, а на підставі їх фізичних властивостей.
Кожен тип сигнальної послідовності пов'язується зі специфічним рецептором. який направляє білок до певної органелле. Коли білок досягає органели, він транслоціруется всередину неї по мембранному каналу. Від моменту розпізнавання сигнальної послідовності, при синтезі білка або після його завершення, залежить тип транслокации. Котрансляціонная транслокация відбувається у випадках, коли сигнальна послідовність впізнається в процесі синтезу білка. При цьому, рибосома, на якій синтезується білок, зв'язується з мембраною, і утворюється білок переноситься в канал транслокации. Посттрансляційна транслокация відбувається, коли сигнальна послідовність впізнається після завершення синтезу білка.
Більшість білків потрапляють в ЕПР шляхом котранс-ляціонному транслокации. Відразу після виходу сигнальної послідовності з рибосоми з нею зв'язується частка, що розпізнає сигнал (SRP). Рибосома і зростаючий білок позиціонуються на мембрані ЕПР за рахунок взаємодії між SRP і її рецептором. Потім рибосома разом зі зростаючою ланцюгом займають канал, по якому білок проходить через мембрану. Серцевину каналу утворює комплекс Sec61, навколо - велика група білків, що беруть участь в транслокації. Всі разом це називається транслоконом. При взаємодії з сигнальної послідовністю канал відкривається, що дозволяє ланцюга увійти в нього таким чином, який виключає транспорт інших молекул через мембрану ЕПР. Трансляція триває до тих пір, поки рибосома залишається пов'язаної з каналом, і білок транспортується по ньому в люмен.
Інтеграція білка в мембрану ЕПР починається в той момент, коли трансмембранний домен починає транслюватися і входити в канал. Оскільки трансмембранні домени мають гидрофобностью, вони впізнаються каналом, і проходять через його стінки в ліпідний бішар мембрани. Після впізнавання трансмембранного домену транспорт утворюється білка через мембрану припиняється. Трансляція, однак, триває, що призводить в виходу подальший ділянок поліпептидного ланцюга в цитозоль. Для повної інтеграції мембранних білків з декількома трансмембранними доменами, ймовірно, необхідно багаторазове відкриття і закриття каналу.
Процес інтеграції мембранних білків ускладнюється необхідністю їх певної орієнтації в мембрані. Очевидний але, що вона залежить від властивостей трансмембранних доменів білків. Однак не ясно, як домени повинні взаємодіяти з каналом, мембранними ліпідами, або один з одним, щоб визначити орієнтацію білків.
При транслокації в ЕПР багато білків піддаються ковалентного модифікації. Зазвичай сигнальна послідовність видаляється пептидаз незабаром після того, як білок увійшов в канал. Решта ділянок молекули транслоціруемого білка часто модифікуються після того, як вони пройшли в люмен. До білку можуть додаватися залишки цукрів олігосахарідтрансферазой, або за рахунок дії протеіндісульфідізомерази (ПДИ) в молекулі можуть утворитися дисульфідні зв'язки. Деякі повністю транслоцироваться білки розщеплюються поруч з С-кінцевим ділянкою і приєднуються до глікозілфос-фатіділінозітолу (ДФІ), фосфоліпіди, який пов'язує їх з мембраною.
Після потрапляння в люмен білки починають набувати нативную структуру. Це забезпечується великою кількістю різноманітних шаперонов. BiP і Grp94 безпосередньо взаємодіють з неструктурованими білками. Кальнексін і кальретікулін зв'язуються з цукровими залишками, які додаються до білків при транслокації. Вони також беруть участь в процесі додавання глюкозного залишку до поліпептидного ланцюга. Наявність цього залишку дозволяє судити про те, наскільки правильною нативной структурою володіє білок ПДИ бере участь в перегрупування дисульфідних зв'язків, яка супроводжує структурування білка. Після придбання білками правильної нативной структури вони вже не реагують з шаперонами і отримують можливість вийти з ЕПР в апарат Гольджі Якщо кілька спроб освіти білком правильної нативной структури виявилися безуспішними або білок не може утворити комплекс з іншими білками, то він повертається в канал і назад в цитозоль за рахунок ретроградної транслокации. Коли він потрапляє в цитозоль, то піддається деградації в протеосомах.
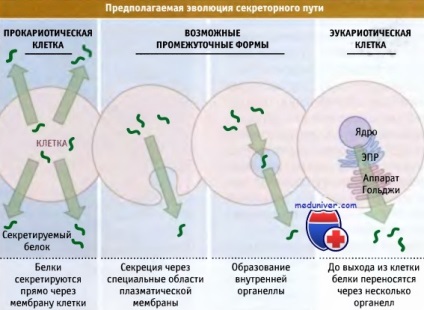
володіє функцією секреції білка.
У клітинах еукаріот білки безпосередньо не секретируются черезплазматичну мембрану,
а транспортуються в люмен ЕПР, який за складом нагадує зовнішнє оточення клітини.
Накопичення в ЕПР великих кількостей білків, які не мають нативної структури, викликає відгук неструктурованих білків. Це ланцюг сигналів від ЕПР до ядра, які забезпечують додатковий синтез шаперонов. Сигнал опосередковується трансмембранними білками, резидентними компонентами ЕПР, які дізнаються присутність неструктурованих білків, не пов'язаних з BiP. При цьому запускаються події, в результаті яких змінюється експресія генів, і ЕПР отримує можливість подолати наслідки надлишку неструктурованих білків. По-випадку вищих еукаріот, при триваючому стані стресу, ці ж процеси викликають клітинну загибель.
Імпорт білків в мітохондрії і хлоропласти відбувається після закінчення трансляції. Для обох органел характерно існування двох мембран. Білки можуть бути локалізовані в одній з мембран, в межмембранном просторі або всередині органели. Кожна мембрана має свій транслокон. У мітохондрій вони звуться ТОМ для зовнішньої мембрани і TIM для внутрішньої мембрани, а у хлоропластів ТОС і TIC відповідно. Сигнальні послідовності впізнаються транслоконом зовнішньої мембрани. Транслокони внутрішньої і зовнішньої мембран пов'язані між собою, так що імпортуються білки переносяться між ними безпосередньо. Білки мітохондрій можуть переноситися через обидві мембрани і потім при впізнаванні окремої сигнальної послідовності знову прямувати до внутрішньої мембрані.
У транслокации білків хлоропластів через мембрану внутрішньої органели, званої Тилакоїди, також бере участь особлива сигнальна послідовність.
Транслокация белов в мітохондрії відбувається за рахунок електрохімічного градієнта через внутрішню мембрану і сил взаємодії між імпортними білками і шаперонами в матриксі мітохондрій. За рахунок чого відбувається транслокація в хлоропласти, залишається неясним. Ми також не знаємо, яким чином відбувається інтеграція білків в мембрани цих органел.
Транспорт білків в пероксисоми відбувається посттрансляційних, але відрізняється від їх транслокації в інші органели. При імпорті в пероксисоми білок проходить через одну мембрану, і процес починається після того, як він придбав в цитоплазмі нативную структуру. Сигнальна послідовність для пероксисом впізнається в цитоплазмі за участю білків, які залишаються пов'язаними з субстратом в момент його транслокації. Білки-переносники диссоциируют тільки після того, як вони опинилися всередині органели, і повертаються в цитозоль для подальшого використання. Походження білків мембрани пероксисом залишається невідомим.
Поряд з імпортом. дозріванням і розподілом білків, ЕПР виконує в клітині ще кілька функцій. Його функції відображаються в структурі. Транслокация і дозрівання білків відбуваються в гранулярному ЕПР, вкритому рибосомами. Гладкий ЕПР відрізняється від шорсткого. Зазвичай він являє собою трубочки, організовані в динамічну мережу, розгалужену по всьому цитозолю. Гладкий ЕПР часто пов'язаний з елементами цитоскелету і контактує з іншими мембранами клітини. До числа його функцій відноситься синтез ліпідів для всіх клітинних мембран. Ліпіди повинні якимось чином транспортуватися з ЕПР в інші мембрани, проте невідомо, як це відбувається. Можливо, що це відбувається в точках контакту гладкого ЕПР з іншими мембранами. ЕПР також служить резервуаром внутрішньоклітинного кальцію. Кальцій виходить у відповідь на отриманий кліткою сигнал, і після виконання своїх функцій закачується назад в органеллу.
У спеціалізованих клітинах в гладкому ЕПР можуть також синтезуватися жиророзчинні гормони або знешкоджувати потенційно небезпечні для клітини хімічні сполуки. У клітинах, спеціалізованих для виконання будь-якої функції, що здійснюється за рахунок ЕПР, наприклад секретуючих багато білка, або утворюють стероїдні гормони, може додатково утворюватися гранулярний або гладкий ЕПР, і займати в них більшу частину цитозоля. У таких високоспеціалізованих клітинах як скелетні м'язи, ЕПР також надзвичайно високоспеціалізованої за своїм складом і будовою. Саркоплазматический ретикулум, який представляє собою спеціалізований гладкий ЕПР, обгорнутий навколо саркомерів скелетних м'язів і пристосований для доставки іонів кальцію, що стимулюють м'язове скорочення.