Поняття про розчини
Розчини є однією з різновидів дисперсних систем (від лат. Disperse - розсіювати, розсипати). Всі дисперсні системи складаються з дисперсійного середовища (розчинника) і дисперсної фази (розчиненої речовини). Залежно же від того, в якому агрегатному стані і в якому ступені дроблення (дисперсності) речовини входять до складу дисперсних систем, їх можна розділити на тверді, рідкі або газоподібні розчини, справжні, колоїдні розчини, суспензії, суспензії і т.д.
Класифікація розчинів за розмірами розчинених частинок (за ступенем дроблення дисперсної фази)
За розмірами частинок розчини поділяють на суспензії, колоїдні розчини та істинні розчини. Крім різниці в розмірах часток, ці розчини відрізняються ще й стійкістю в часі.
Таким чином, зрозуміло, що звичайні розчини (істинні розчини) представляють собою суміш розчинника і розчиненої речовини, в якому речовина подрібнена на окремі молекули (або іони). Але якщо суспензії досить легко відрізнити від справжніх розчинів за мутностью, то колоїдні розчини на перший погляд відрізнити досить важко. Однак колоїдні розчини легко визначити за допомогою простого досвіду: все колоїдні розчини повинні обов'язково проявляти ефект Тиндаля. Ефект Тиндаля полягає в тому, що коли в затемненій кімнаті через стакан з колоїдним розчином пропустити промінь світла, то збоку цей промінь дуже добре видно. Ефект Тиндаля ми спостерігаємо досить часто, коли дивимося на промінь світла, який пробивається через фіранки в затемнену пильну кімнату або на сніг, що падає, в світлі автомобільних фар або вуличних ліхтарів у вечірній час. Справжні розчини ефекту Тиндаля не виявляють, тобто промінь світла, пропущений через стакан з таким розчином, з боку побачити неможливо.
Найчастіше зустрічаються розчини, в яких дисперсійним середовищем (розчинником) рідини і, зокрема, вода.
Отже, до істинних розчинів відносять розчини на основі рідких розчинників, в яких речовина подрібнене до молекулярного рівня.
Розчини - це однорідні (гомогенні) суміші змінної структури, що складаються з декількох компонентів і продуктів їх взаємодії.
Компонент розчину, що знаходиться в тому ж агрегатному стані, що й розчин, називають розчинником (або дисперсійним середовищем), а інші компоненти називають розчиненими речовинами (або дисперсійної фазою). Якщо розчин складається з суміші двох рідин, то розчинником називають ту речовину, якого більше. А якщо одним з компонентів є вода, то, незалежно від її змісту, зазвичай в таких випадках розчинником називають воду.
Слід також зазначити, що хоча розчини і називають сумішами, їх треба відрізняти від звичайних механічних сумішей. Так само, як і суміші, розчини не мають постійного складу (як і в разі хімічних сполук), і їх можна розділити на індивідуальні речовини (якщо не відбувається незворотних хімічних процесів). Проте основною ознакою, що характеризує розчини, є однорідність. Крім того, на відміну від звичайних сумішей, розчинів притаманні взаємодії між частинками розчинника і розчиненої речовини. На підставі цього можна стверджувати, що газоподібні розчини є механічними сумішами газів.
Механізм розчинення і теплові ефекти при розчиненні
Процес розчинення безперечно можна назвати і фізичним, і хімічним процесом. 8 одного боку, при розчиненні речовини відбувається її дроблення, що робить схожим його на фізичний процес. З іншого боку, при розчиненні обов'язково спостерігається поглинання або виділення теплоти і в деяких випадках відбуваються утворення нових речовин. Однак процес розчинення не відносять ні до того, ні до іншого. Його називають фізико-хімічним процесом. І це стане більш зрозуміло, якщо розглянути процес розчинення.
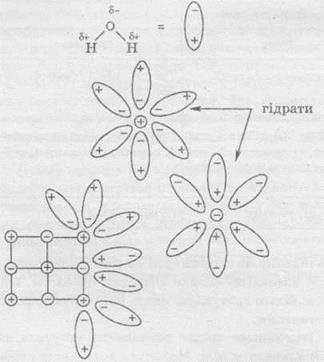
Розглянемо процес розчинення кристала натрій хлориду у воді. Молекула води являє собою диполь, у якого є позитивно і негативно заряджені полюси. Внаслідок цього, при попаданні кристала солі в воду, цей кристал оточують молекули води, які відповідним чином орієнтуються навколо позитивно і негативно заряджених іонів. І, звичайно ж, молекули води починають притягувати іони до себе. Коли сила тяжіння іонів до молекул води стає більше, ніж сила тяжіння до кристала, то іон в оточенні молекул води переходить в розчин.
Іони або молекули, оточені молекулами розчинника, називають сольватамі або, в разі водних розчинів, гідратами.
Отже, в процесі розчинення можна виділити три стадії:
1) взаємодія частинок розчинної речовини з молекулами розчинника - сольватация (в разі водних розчинів - гідратація);
2) руйнування структури розчинної речовини - руйнування кристалічної решітки - іонізація;
3) розподіл сольватованіх частинок в обсязі розчинника - дифузія.
В результаті першого процесу відбувається виділення теплоти за рахунок утворення нових зв'язків між частинками, а в результаті другого - поглинання тепла (енергія витрачається на руйнування зв'язків між частинками в кристалічній решітці). У зв'язку з цим загальний тепловий ефект процесу розчинення дорівнює сумі двох теплових ефектів названих процесів: якщо при гідратації виділяється енергії більше, ніж витрачається на руйнування кристалічної решітки, то внаслідок розчинення енергія виділяється і розчин нагрівається (процес екзотермічний) і навпаки (ендотермічний).
якщо (теплота поглинається);
якщо (теплота виділяється).