Валентні стану атомів углерода.Образованіе зв'язків.
Атом З ним-т заряд +6.
На останньому енергетичному рівні атома вуглецю міститься 4 електрона, два з яких займають 2s- орбиталь, що має сферичну форму, а два електрона займають 2р-орбіталі, мають гантелеподобную форму. При порушенні один електрон з 2s-орбіталі може переходити на одну з вакантних 2р-орбіталей. Цей перехід вимагає деяких енергетичних витрат (403 кДж / моль). В результаті збуджений атом вуглецю має 4 неспарених електрона і його електронна конфігурація виражається формулою 2s 1 2p 3
Збуджений вуглець: 1s22s12px12py12pz1
Гібридизація - явище взаємодій-я м \ у собою молекулярних орбіталей, близьких по енергії і мають спільні елементи симетрії, з обр-ем гібридних орбіталей з більш низькою енергією.
sp3-гібридизація (1 валентний стан вуглецю): харак-на для гомологічного ряду метану.
Хімічні зв'язки, що виникають в метані м \ у атомами вуглецю і водню отн-ся до типу # 948; -зв'язків (sp 3 -s-зв'язок). # 963;-зв'язку м \ у вуглецем і воднем обр-ни sp3-гібридними хмарами вуглецю і хмарами водню. головна відмінність # 963; -зв'язків від ін полягає в тому, що перекривання орбіталей осущ-ся вздовж лінії, що з'єднує ядра атомів.
sp2-гібридизація (2 валентний стан атома вуглецю): обр-ся при взаємодій-і двох р-орбіталей (рx і py) і s-орбіталі, причому утворилися sp2-орбіталі лежать в одній площині і обр-т кут 120 °. Харак-на для гомологічного ряду етилену.
Подвійний зв'язок обр-на гібрідізоваться sp2 -орбіталямі, а п-зв'язок обр-на негібрідізованнимі р -орбіталямі.
sp-гібридизація (3 валентний стан атома вуглецю): обр-ся при взаємодій-і s-орбіталі з px-орбиталью.
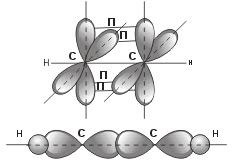
Для sp-гібридизації хар-на лінійна орієнтація молекулярних орбіталей. Хар-на для гомолог-го ряду ацетилену. # 963;-зв'язок обр-на гібридним sp-хмарою вуглецю в одній площині, а 4 p-електронних хмари обр-т дві п-зв'язку під взаімоперпендікулярних площинах.
Оцінка розподілу електронної щільності в молекулах орг в-в. Способи передачі електронного влдіянія атомів.
Всі складові молекулу атоми нах-ся у взаємозв'язку і відчувають взаємний вплив. Це вплив передається, в основному, ч \ з систему ковалентних зв'язків, з пом \ ю т.зв. електронних еффектов.Електроннимі ефектами наз-т зміщення електронної густини в мовляв-ле під впливом заступників.
Атоми, пов'язані полярної зв'язком, несуть часткові заряди, що позначаються грецькою буквою "дельта" (# 948;). Зсув електронної щільності по ланцюгу простих С-С зв'язків наз-ся індуктивним ефектом і позначається I.
Індуктивний ефект передається по ланцюгу з загасанням. Напрямок зміщення електронної щільності всіх s -зв'язків позначається прямими стрілками.
У завис-ти від того, видаляється чи електронна щільність від розглянутого атома вуглецю або наближається до нього, індуктивний ефект називають негативним (-I) або позитивним (+ I). Знак і величина індуктивного ефекту визначаються-ються відмінностями в електронегативності між розглянутим атомом вуглецю і групою, що його викликає.
Атом, "відтягували" електронну щільність s-зв'язку в свою сторону, набуває негативний заряд # 948; -. При розгляді пари атомів, пов'язаних ковалентним зв'язком, більш електронегативний атом, який відсуває на себе атоми наз-ют акцептором. він має негативний індуктивним ефектом. Його партнер по s-зв'язку відповідно буде мати рівний за величиною дефіцит електронної щільності, тобто частковий позитивний заряд # 948; +, буде наз-ся донором. володіє позитивним індуктивним ефектом.
+I-ефект виявляють алифатические вуглеводневі радикали, тобто алкільні радикали (метил, етил і т.д.). Більшість функціональних груп проявляють -I-ефект: галогени, аміногрупа, гидроксильная, карбонильная, карбоксильная групи.
Індуктивний ефект проявляється і в разі, коли пов'язані атоми вуглецю різні станом гібридизації.
Вплив заступника на розподіл електронної щільності, що передається по p-зв'язків, називають мезомерним ефек-том (М). Мезомерний ефект також може бути негативним і позитивним. У структурних формулах його зображують вигнутою стрілкою, що починається у центру електронної щільності і завершується в тому місці, куди зміщується електронна щільність.
Сполучення-явище обр-я з-електронної хмари, загального для 3 або більше З атомів.
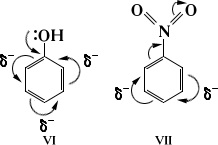
Наявність електронних ефектів веде до перерозподілу електронної щільності в молекулі і появи часткових зоря-дів на окремих атомах. Це визначає реакційну здатність молекули.