
Головна | Про нас | Зворотній зв'язок
Дофамін утворюється з тирозину в нирках, надниркових залозах, синаптичних гангліях і нервах, є нейромедіатором ингибирующего типу. В інших клітинах є попередником інших катехоламінів (адреналіну і норадреналіну).
Норадреналін утворюється в результаті гідроксилювання дофаміну в клітинах нервової тканини, мозковій речовині надниркових залоз. Функціонує як медіатор.
Адреналін - продукт метилювання
В організмі є механізми, що дозволяють руйнувати біогенні аміни.
1. Метилирование по оксигрупи тих амінів, які такі групи містять, або включають оксигрупи в свою молекулу після гідроксилювання.
Ферменти - О-метилтрансферази. Вони переносять метильную групу на кисень. Джерело метильного радикала: S-Аденозілметіонін.
Після приєднання аденільного залишку АДФ до сірки метіоніну, метильная група метіоніну стає дуже мобільною і легко переноситься на різні речовини. У тому числі і на кисень оксигрупп.
2. Окислення аміну по аминогруппе з метою дезаминирования.
Головний шлях інактивації біогенних амінів - їх окислення під дією оксидаз з відщепленням аміногрупи. В результаті зникає біологічна активність аміну.
Оксидази біогенних амінів: моноамінооксидази (МАО), діамінооксідази (ДАО), поліамінооксідаза.
Оксидази віднімають два протони і два електрони і передають їх відразу на кисень. Утворюється перекис водню, а амін перетворюється в імінну. Цей імін легко гідролізується без участі ферменту і перетворюється в альдегід. Простетичної групою ферментів оксидаз є ФАД або ФМН, т. Е. Вони є флавопротеїнами.
Друга реакція (гідроліз) необоротна. Утворився в результаті альдегід легко окислюється до карбонової кислоти, яка розпадається до СО2 і H2O. МАО в клітці більше, ніж ДАО.
Пригнічення МАО Привілля до уповільнення розпаду біогенних амінів. Такі ліки продовжують період існування біогенних амінів, що особливо важливо при їх нестачі.
Ці речовини відіграють роль антидепресантів і використовуються, зокрема, при лікуванні шизофренії.
Амінокислоти декарбоксилируется в цитоплазмі, а окислення амінів відбувається в зовнішній мембрані мітохондрій. Оскільки реакція декарбоксилювання амінокислот і руйнування біогенних амінів відбуваються не одночасно, то біогенні аміни можуть деякий час існувати і виконувати свою біологічну функцію.
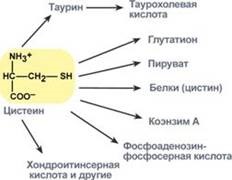
Шляхи метаболізму цистеїну
Цистеїн є надзвичайно важливою амінокислотою в зв'язку з тим, що це єдине джерело органічної сірки для клітин організму. В результаті реакцій метаболізму ця сірка переходить до складу інших серусодержащих речовин - фосфоаденозінфосфосерная кислота (ФАФС), коензим А, глутатіон, сульфовані похідні вуглеводів (хондроитинсульфат, кератансульфатів, дерматансульфат) або виводиться нирками у вигляді сульфатів.
Одним з похідних цистеїну є таурин, що володіє наступними функціями:
· Є обов'язковим компонентом жовчних кислот
· Грає роль внутрішньоклітинного антиоксиданту,
· Є дані про функції таурину як гальмівного нейромедіатора.
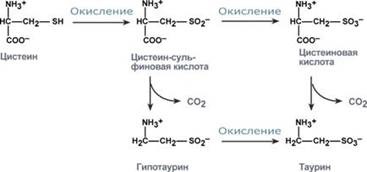
Порушення обміну метіоніну і цистеїну
В даний час найактуальнішим порушенням є гомоцистеїнемії - накопичення гомоцистеїну в крові.
Всі причини даного порушення ділять, як мінімум, на дві групи:
1. Спадковий дефект ферментів
Тут розглядаються три ферменту - метіонінсінтаза, цистатіонін-синтаза, метилен-ТГФК-редуктаза:
гомозиготний (аутосомно-рецесивно) дефект цистатіонін-синтази (вроджена гомоцистинурія, пірідоксінзавісімая форма), частота 1: 100000, спостерігається підвищення рівня загального гомоцистеїну натщесерце до 40 разів.
набагато частіше причиною помірної гіпергомоцистеїнемії є гомозиготний дефіцит метилен-тетрагідрофолат-редуктази (пірідоксінрезістентная форма), при якій фермент має половинну активність від норми.
порушена активність метіонінсінтази, одночасно спостерігається підвищення концентрації метилмалоновой кислоти. Описано всього декілька випадків такого дефекту. Передбачається, що дефектним є фермент кобаламин-редуктаза, робота якого передує утворенню дезоксиаденозилкобаламін і метилкобаламина.
2. Недостатність вітамінів В12, В6, В9, які беруть участь у метаболізмі гомоцистеїну