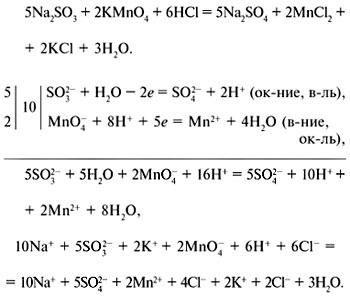ЗАНЯТТЯ 10 10-й клас (перший рік навчання)
Окислювально-відновні реакції План
1. Редокс (ОВР), ступінь окислення.
2. Процес окислення, найважливіші відновники.
3. Процес відновлення, найважливіші окислювачі.
4. Окисно-відновна двоїстість.
5. Основні типи ОВР (міжмолекулярні, внутрішньо-молекулярні, диспропорционирование).
7. Методи складання рівнянь ОВР (електронний та електронно-іонний баланс).
Всі хімічні реакції за ознакою зміни ступенів окислення беруть участь в них атомів можна розділити на два типи: ОВР (що проходять із зміною ступенів окислення) і не ОВР.
Ступінь окислення - умовний заряд атома в молекулі, розрахований, виходячи з припущення, що в молекулі існують тільки іонні зв'язку.
П р а в и л а д л я про п р е д е л е н і я з т е п е н е й о к і з л е н і я
Ступінь окислювання атомів простих речовин дорівнює нулю.
Сума ступенів окислення атомів в складному речовині (в молекулі) дорівнює нулю.
Ступінь окислювання атомів лужних металів +1.
Ступінь окислювання атомів лужноземельних металів +2.
Ступінь окислювання атомів бору, алюмінію +3.
Ступінь окислювання атомів водню +1 (в гидридах лужних і лужно-земельних металів -1).
Ступінь окислювання атомів кисню -2 (в пероксид -1).
Будь-яка ОВР є сукупність процесів віддачі і приєднання електронів.
Процес віддачі електронів називають окисленням. Частки (атоми, молекули або іони), що віддають електрони, називають відновниками. В результаті окислення ступінь окислення відновлювача збільшується. Восстановителями можуть бути частки в нижчій або проміжної ступенях окислення. Найважливішими восстановителями є: всі метали у вигляді простих речовин, особливо активні; C, CO, NH3. PH3. CH4. SiH4. H2 S і сульфіди, галогеноводороди і галогеніди металів, гідриди металів, нітриди і фосфіди металів.
Процес приєднання електронів називають відновленням. Частинки, які беруть електрони, називають окисниками. В результаті відновлення ступінь окислення окислювача зменшується. Окислювачами можуть бути частинки у вищій або проміжної ступенях окислення. Найважливіші окислювачі: прості речовини-неметали, що володіють високою електронегативність (F2. Cl2. O2), перманганат калію, хромати і дихромати, азотна кислота і нітрати, концентрована сірчана кислота, хлорне кислота і перхлорати.
Речовини, що містять частинки в проміжній ступеня окислення, можуть виступати як в ролі окислювачів, так і в ролі відновників, тобто проявляють окисно-відновну двоїстість. Це сірчиста кислота і сульфіти, хлорнуватиста кислота і гіпохлорити, пероксиди та ін.
Розрізняють три типи окисно-відновних реакцій.
Міжмолекулярні ОВР - окислювач і відновник входять до складу різних речовин, наприклад:
Внутрішньомолекулярні ОВР - окислювач і відновник входять до складу одного речовини. Це можуть бути різні елементи, наприклад:
або один хімічний елемент в різних ступенях окислення, наприклад:
Диспропорционирование (самоокислення-самовідновлення) - окислювачем і відновником є один і той же елемент, що знаходиться в проміжній ступеня окислення, наприклад:
ОВР мають величезне значення, оскільки більшість реакцій, що протікають в природі, відносяться до цього типу (процес фотосинтезу, горіння). Крім того, ОВР активно використовуються людиною в його практичній діяльності (відновлення металів, синтез аміаку):
Для складання рівнянь ОВР можна використовувати метод електронного балансу (електронних схем) або метод електронно-іонного балансу.
Метод електронного балансу:
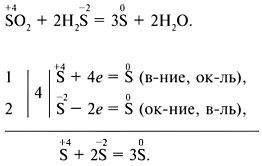
Метод електронно-іонного балансу: