До 1913 р були три експериментальних факту, які не знаходили пояснення в рамках класичної фізики:
- Емпіричні закономірності лінійного спектра атома водню, виражені у формулі Бальмера - Ридберга.
- Ядерна модель атома Резерфорда.
- Квантовий характер випромінювання і поглинання світла (теплове випромінювання і фотоефект).
Для можливості вирішення виниклих труднощів Н. Бор (датський вчений) сформулював три постулати для водню і водородоподобних атомів - ядром з зарядом Ze і один електрон рухається навколо ядра.
I - й постулат - постулат стаціонарних станів:
В системі існують деякі стаціонарні стани, які не змінюються в часі без зовнішніх впливів. У цих станах атом не випромінює світла.
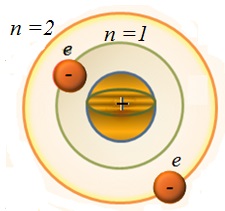
У стаціонарному стані атома електрон, рухаючись по круговій орбіті з прискоренням, не випромінює світла, повинен мати дискретні (квантовані) значення моменту імпульсу
III - й постулат - правило орбіт:
Випромінювання випускається або поглинається у вигляді світлового кванта енергії при переході електрона з одного стаціонарного стану в інший.
Величина світлового кванта дорівнює різниці енергій стаціонарних станів, між якими відбувається перехід електрона
.
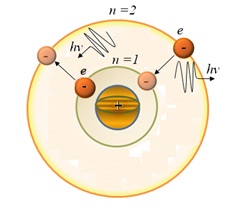
Набір можливих дискретних частот
Квантових переходів і визначають лінійчатий спектр атома.
§4 Досліди Франка і Герца
Перший і третій постулати Бора були експериментально підтверджені в дослідах Франка і Герца (німецькі вчені) в 1913 р
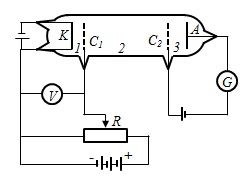
13 Па) містила катод (К), дві сітки (С1 і С2) і анод (А). Електрони, що випускаються катодом прискорювалися різницею потенціалів, яка додається між До і С1. Між сіткою С2 і А прикладений невеликий затримує потенціал 0,5 В. Електрони, прискорені в області, де відчувають зіткнення з атомами ртуті. Електрони, які мають після зіткнення достатню енергію для подолання затримує потенціалу в області 3 (по малюнку), досягають анода. При непружних зіткненнях електронів з атомами ртуті останні можуть порушуватися. Відповідно до теорії Бора, кожен з атомів ртуті може отримати лише цілком певну енергію, переходячи при цьому в одне з порушених станів. (Основний стан n = 1, порушену - n = 2, 3, 4, ...) Тому, якщо в атомах дійсно існують стаціонарні стани, то електрони, стикаючись з атомами ртуті, повинні втрачати енергію дискретно, певними порціями, рівними різниці енергій відповідних стаціонарних станів.
З досвіду випливає, що при збільшенні прискорюючого потенціалу до 4,86 В анодний струм зростає монотонно. Пройшовши при U = 4,86 В через максимум, анодний струм різко падає. Потім знову зростає при зміні U = 4,86 ÷ 2 · 4,86 В. При U = 2 · 4,86 В падає і потім знову зростає і т.д.
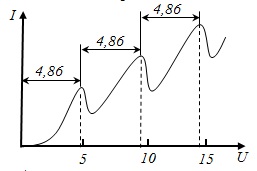
Атом ртуті, переходячи в основний стан, випромінює світло з λ = 255 нм (УФ), який і був виявлений в досвіді. Таким чином, досвід Франка і Герца підтвердив I і III- ї постулати Бора.
§5 Спектр атома водню по Бору
При русі електрона по орбіті сила Кулона є доцентровою. тоді
За II - му постулату Бора
Радіус першої боровськой орбіти дорівнює
Внутрішня енергія атома дорівнює сумі кінетичної і потенційної енергії
Підставивши в формулу вираз для r, отримаємо дозволені значення енергії:
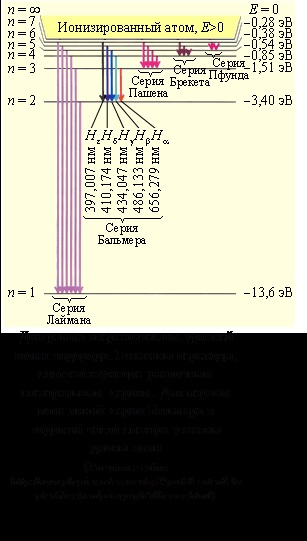
де знак мінус означає, що електрон знаходиться в зв'язаному стані. З формули (1) випливає, що енергетичні стану атома утворюють послідовність енергетичних рівнів, що змінюються в залежності від значення n. Ціле число n в (1), що визначає енергетичні рівні атома, називається головним квантовим числом. Енергетичне стан з n = 1 є основним станом. Стан з n> 1 називається збудженим. Енергетичний рівень, відповідний основного стану, називається основним, всі інші - збудженими.
Іонізація атома - відрив електрона від атома. Енергія іонізації атома водню дорівнює 13,6 еВ.
Згідно II - му постулату Бора при переході атома водню з стаціонарного стану n в стаціонарний стан m (n> m) випускається квант з енергією
- формула Бальмера - Ридберга,
де - постійна Рідберга.
Теорія Бора внутрішньо суперечлива: застосовує закони класичної фізики, а грунтується на квантових постулатах. Теорія Бора не може пояснити спектр атома гелію.