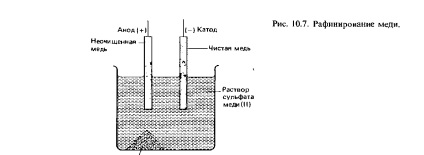
Очищення таких металів, як мідь і цинк, може здійснюватися за допомогою електролізу. Очищення металів називається рафінуванням (див. Розд. 10.5). На рис. 10.7 схематично зображено процес очищення міді. Неочищена мідь грає в цьому процесі роль анода, а очищена мідь-роль катода; в якості електроліту може використовуватися розчин сульфату міді (II). На аноді протікає полуреакции
Сu (тв.) = Cu2 + (водн.) + 2е-
Домішки, що вивільняються при розчиненні неочищеної міді на аноді, опускаються на дно електролізера, утворюючи так званий анодний мул. Цей мул може містити дорогоцінні метали, наприклад золото і срібло. Перехідні в розчин іони міді розряджаються і осідають на чистому мідному катоді. Ця полуреакции описується рівнянням
Cu2 + (водн.) = Сu (тв.) + 2е-
Домішки (анодний мул)
Нанесення гальванічних покриття
У цьому процесі нанесення покриття (електроосадження) здійснюється на катоді. Катод занурюють в електроліт, який містить іони електроосаждаемого металу. Як анода використовується пластина або стрижень з того металу, яким наносять покриття. Для успішного проведення електроосадження слід ретельно контролювати силу електричного струму, концентрацію електроліту і температуру. Крім того, необхідно попередньо піддати очищенню катод.
Нанесення гальванічного покриття може включати цілий ряд стадій. Наприклад, покриття заліза хромом включає чотири стадії:
1. Очищення залізного предмета, що грає роль катода, за допомогою сірчаної кислоти з наступним промиванням деионизированной водою.
2. Покриття залізного катода міддю.
3. Подальше покриття катода нікелем з метою запобігання корозії.
4. Остаточне покриття предмета хромом.
Так називається процес покриття алюмінієвих предметів оксидом алюмінію. У цьому процесі покриваються предмет грає роль анода, а в якості електроліту використовується розбавлена сірчана кислота. Покриття з оксиду алюмінію охороняє предмет від корозії.
Отримання хімічних речовин
Найважливішим прикладом подібного застосування електролізу є отримання гідроксиду натрію, водню і хлору в електролізері з ртутним катодом. Детальний опис цього процесу наводиться в розд. 13.3.
На поверхні колоїдних частинок, зважених в розчині, часто є електричні заряди через адсорбції іонів або електронів. Наприклад, частинки золота в водному золі золота адсорбируют на своїй поверхні гідроксидні іони. При пропущенні електричного струму через золь негативно заряджені частинки золю мігрують до анода (рис. 10.8). Міграція заряджених колоїдних частинок до якого-небудь електроду називається електрофорез. (Інша назва електрофорезу-катафорез.)
Електрофорез знаходить важливі застосування в техніці, медицині та біохімії. Він може використовуватися для поділу, ідентифікації та кількісного визначення білків і жирів (див. Розд. 20.3) в крові.