Фізичні властивості [| ]
Пропілен є газоподібна речовина з низькою температурою кипіння tкип = -47,6 ° C і температурою плавлення tпл = -187,6 ° C, оптична щільність d20 4 = 0,5193. щільність по повітрю = 1.45 (за довідником Баратова)
Хімічні властивості [| ]
Має значну реакційною здатністю. Його хімічні властивості визначаються подвійний вуглець-вуглецевим зв'язком. p-зв'язок, як найменш міцна і доступніша, при дії реагенту розривається, а вивільнені валентності вуглецевих атомів витрачаються на приєднання атомів, з яких складається молекула реагенту. Всі реакції приєднання протікають по подвійному зв'язку і складаються в розщепленні π-зв'язку алкена і освіті на місці розриву двох нових σ-зв'язків.
Найчастіше реакції приєднання йдуть по гетеролітичні типу, будучи реакціями електрофільного приєднання.
Приєднання галогенів (галогенирование) [| ]
Реакцію галогенування зазвичай проводять в розчиннику при звичайній температурі. Галогени легко приєднуються за місцем розриву подвійного зв'язку з утворенням дігалогенопроізводних. Легше йде приєднання хлору і брому, важче - йоду. Фтор взаємодіє з вибухом.
Приєднання водню (реакція гідрування) [| ]
H 2 C = C H # X2212; C H 3 + H 2 # X2192; H 3 C # X2212; C H 2 # X2212; C H 3 C = CH-CH_ + H _ >> \ rightarrow C-CH_-CH _ >>>Приєднуючи водень в присутності каталізаторів (Pt, Pd, Ni), пропілен переходить в граничний вуглеводень - пропан.
Приєднання води (реакція гідратації) [| ]
Пропілен реагує з водою з утворенням одноатомного спирту изопропанола. при цьому подвійний зв'язок розкривається.
Приєднання галогеноводородов (HHal) [| ]
Відбувається за правилом Марковникова. Водень кислоти HHal приєднується до найбільш Гідрований атому вуглецю при подвійному зв'язку. Відповідно залишок Hal зв'язується з атомом вуглецю, при якому знаходиться менше число атомів водню.
Приклад гідрогалогенірованіе - отримання бромпохідні пропану при реакції бромоводорода і пропилену.
Горіння на повітрі [| ]
З киснем повітря газоподібний пропилен утворює вибухові суміші.
Окислення [| ]
У слабощелочной або нейтральної водному середовищі пропілен окислюється перманганатом калію. що супроводжується знебарвлення розчину KMnO4 і освітою гликолей (з'єднань з двома гідроксильних груп при сусідніх атомах вуглецю). Ця реакція отримала назву реакції Вагнера.
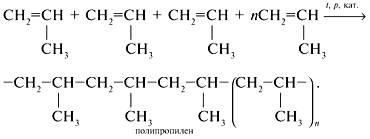
Полімеризація [| ]
Умови реакції: нагрівання, присутність каталізаторів. З'єднання молекул відбувається шляхом розщеплення внутрішньомолекулярних π-зв'язків і утворення нових міжмолекулярних σ-зв'язків.
Окислення киснем повітря в пропіленоксіда [| ]
При нагріванні в присутності срібних каталізаторів:
Отримання [| ]
У лабораторії [| ]
1. Відщеплення галогеноводорода від галогеналкілов при дії на них спиртового розчину лугу:
3. Дегідратація ізопропілового спирту (відщеплення води). В якості каталізатора використовують кислоти (сірчану або фосфорну) або Аl2 O3:
4. Відщеплення двох атомів галогену від дігалогеноалканов. містять галогени при сусідніх атомах С. Реакція протікає під дією металів (Zn і ін.):
У промисловості [| ]
Зазвичай пропілен виділяють з газів нафтопереробки (при крекінгу сирої нафти в киплячому шарі (процес фірми BASF), піролізі бензинових фракцій) або попутних газів, а також з газів коксування вугілля. Існує кілька видів піролізу пропілену: піроліз в трубчастих печах, піроліз в реакторі з кварцовим теплоносієм (процес фірми Phillips Petroleum Co.), піроліз в реакторі з коксівним теплоносієм (процес фірми Farbewerke Hoechst), піроліз в реакторі з піском в якості теплоносія (процес фірми Lurgi), піроліз в трубчастої печі (процес фірми Kellogg), процес Лаврівського - Бродського, автотермічний піроліз по Бартоломе. У промисловості пропилен отримують також дегидрированием алканів у присутності каталізатора (Сr2О3, Аl2О3).
Промисловим способом отримання пропілену поряд з крекингом служить дегідратація пропанола над оксидом алюмінію:
При випуску з виробництва, при товарно-облікових операціях, при перевірці його на відповідність нормативно-технічної документації проводиться відбір проб пропілену за процедурою, описаною в ГОСТ 24975.0-89 "етилен і пропілен. Методи відбору проб". Відбір проби пропілену може проводиться і в газоподібному і в зрідженому вигляді в спеціальні пробовідбірники згідно з ГОСТ 14921.
Застосування [| ]
Виробництво [| ]
Велика частина виробничих потужностей по пропілену зосереджена в Європі, Північній Америці та Азії. В даний час за рік у світі виробляється більше 50 мільйонів тонн пропілену полімерного і хімічного сортів (PG / CG). Велика частина випуску пропілену цих сортів доводиться на частку установок піролізу, де пропілен - побічний продукт виробництва етилену. Установками термічного крекінгу виробляється понад 60% такого пропілену. Нафтопереробними FCC-підприємствами випускається 34%. При дегидрогенизации або метатезіс пропану проводиться 3% пропілену (в даному випадку пропілен є цільовим продуктом).
Пропілен нафтохімічної чистоти (RG) проводиться на нафтопереробних підприємствах світу в кількості, що дорівнює 31,2 мільйонам тонн. Велика частина такого пропілену виробляється на FCC-підприємствах, де пропілен - побічний продукт виробництва бензину та дистилятів. Половина цих пропіленових потужностей інтегрована з нефтехимическими підприємствами, на яких відбувається алкілування пропілену або змішування LPG і пропану.