Радіоактивність мимовільне перетворення атомів одного елемента в атоми інших елементів, що супроводжується випусканням частинок і жорсткого електромагнітного випромінювання. Історична довідка. Беккерель. Навесні +1896 французький фізик А. Беккерель зробив ряд повідомлень про виявлення ним нового виду випромінювання (згодом названому радіоактивним), яке випускається солями урану. Подібно відкритим за кілька місяців до цього рентгенівським променям, вона мала проникаючу здатність, засвічує екрановану чорним папером фотопластинку і іонізованого навколишнє повітря. Гіпотеза, яка привела до відкриття радіоактивності, виникла у Беккереля під впливом досліджень Рентгена. Оскільки при генерації Х-променів спостерігалася фосфоресценція скляних стінок рентгенівської трубки, Беккерель припустив, що будь-який фосфоресцентних світіння супроводжується випусканням рентгенівського випромінювання. Для перевірки цього припущення він помістив різні фосфоресцирующие речовини на загорнуті в чорний папір фотопластинки і отримав несподіваний результат: засвіченою виявилася єдина платівка, з якої стикався кристал солі урану. Численні контрольні досліди показали, що причиною засвічення з'явилася НЕ фосфоресценція, а саме уран, в якому б хімічній сполуці він не знаходився. Властивість радіоактивного випромінювання викликати іонізацію повітря дозволило поряд з фотографічним методом реєстрації застосовувати більш зручний електричний метод, що значно прискорило процес досліджень.
Кюрі. Користуючись електричним методом, Г. Шмідт і М. Кюрі в 1898 виявили радіоактивність елемента торію. У наступному році Дебьерн відкрив радіоактивний елемент актиній. Започаткований подружжям П. і М. Кюрі систематичний пошук нових радіоактивних речовин і вивчення властивостей їх випромінювання підтвердили здогад Беккереля про те, що радіоактивність уранових сполук пропорційна числу містяться в них атомів урану. Серед обстежених мінералів цю закономірність порушувала лише уранова смоляна руда (уранініт), яка виявилася в чотири рази активніше, ніж відповідна кількість чистого урану. Кюрі зробили висновок про те, що в Уранініт повинен міститися невідомий високоактивний елемент. Провівши ретельне хімічне поділ уранініта на складові компоненти, вони відкрили радій, за хімічними властивостями подібний з барієм, і полоній, який виділявся разом з вісмутом.
Резерфорд. У подальших дослідженнях радіоактивності провідна роль належала Е. Резерфорд. Зосередивши увагу на вивченні цього явища, він встановив природу радіоактивних перетворень і супутнього їм випромінювання.
Випромінювання радіоактивних речовин. Природні радіоактивні елементи випускають три види випромінювань: альфа, бета і гамма. У 1899 Резерфорд ідентифікував альфа- і бета-випромінювання; через рік П.Війар відкрив гамма-випромінювання.
Альфа-випромінювання. В повітрі при атмосферному тиску альфа-випромінювання долає лише невелику відстань, як правило, від 2,5 до 7,5 см. В умовах вакууму електричне та магнітне поля помітно відхиляють його від первісної траєкторії. Напрямок та величина відхилень вказують на те, що альфа-випромінювання - це потік позитивно заряджених частинок, для яких відношення заряду до маси (e / m) в точності відповідає двічі іонізованого атома гелію (He ++). Ці дані і результати спектроскопічного дослідження зібраних альфа-частинок дозволили Резерфорду зробити висновок про те, що вони є ядрами атома гелію.
Бета-випромінювання. Це випромінювання має більшу проникаючу здатність, ніж альфа-випромінювання. Як і альфа-випромінювання, воно відхиляється в магнітному і електричному полях, але в протилежну сторону і на більшу відстань. Це вказує на те, що бета-випромінювання є потоком негативно заряджених частинок малої маси. Стосовно e / m Резерфорд ідентифікував бета-частинки як звичайні електрони.
Гамма-випромінювання. Гамма-випромінювання проникає в речовину набагато глибше, ніж альфа- і бета-випромінювання. Воно не відхиляється в магнітному полі і, отже, не має електричного заряду. Гамма-промені були ідентифіковані як жорстке (тобто має дуже високу енергію) електромагнітне випромінювання. Поділ радіоактивного випромінювання в магнітному полі на альфа-, бета- і гамма-промені схематично показано на малюнку.
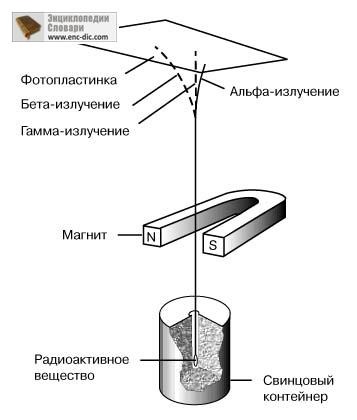
СХЕМА ЕКСПЕРИМЕНТУ, що ілюструє відхилення різних видів радіоактивного випромінювання в магнітному полі.
Теорія радіоактивного розпаду. В процесі емісії радіоактивного випромінювання речовина зазнає ряд змін. Так, наприклад, випромінювання радію супроводжується виділенням газоподібного радону ( "еманацією"). У свою чергу радон, розпадаючись, залишає радіоактивні відкладення на стінках містить його судини. Зібрана при розпаді радію еманація втрачає половину вихідної активності приблизно за 4 доби. Ці та інші не піддаватися інтерпретації експериментальні факти вдалося пояснити за допомогою теорії радіоактивного розпаду атомів, запропонованої Резерфордом і Содді в 1903, а також правила зміщення, сформульованого в 1913 А.Расселом і незалежно від нього фаянсу і Содді. Суть теорії Резерфорда і Содді полягає в тому, що в результаті радіоактивного розпаду відбувається перетворення одного хімічного елемента в інший.
Правило зміщення. Правило зміщення точно вказує, які саме перетворення зазнає хімічний елемент, випускаючи радіоактивне випромінювання.
Емісія альфа- і бета-частинок. Правило зміщення можна пояснити за допомогою ядерної моделі атома, запропонованої Резерфордом в 1911 Відповідно до цієї моделі, в центрі атома знаходиться позитивно заряджене ядро, в якому зосереджена основна частина маси атома. Навколо ядра обертаються електрони, заряд яких компенсує позитивний заряд ядра. Кожному атому приписується свій атомний номер Z, відповідний його порядковому номеру в періодичній таблиці Менделєєва і чисельно рівний заряду ядра, вираженого в одиницях заряду електрона. Альфа-частинка має Z = 2 і масове число (округлений атомний вага) A = 4. Якщо нестійке ядро випускає бета-частинку, то його Z збільшується на одиницю, а масове число не змінюється. Отже, радіоактивний атом перетворюється в наступний по порядку атом таблиці Менделєєва. При емісії альфа-частинки Z і A новоутвореного ядра зменшуються на 2 і 4 одиниці відповідно, а дочірній атом, випробувавши відповідне ізотопічні перетворення, "зміщується" в таблиці Менделєєва вліво від батьківського елемента.
Гамма-випромінювання. Орбітальні електрони, отримавши надлишок енергії, можуть переходити на більш високі енергетичні рівні. Повертаючись в основний (нормальне) стан, вони віддають надлишок енергії у вигляді світла або рентгенівського випромінювання. Ядра атомів, що володіють надлишковою енергією, також можуть переходити в збуджений стан. Подібне порушення часто відчувають ядра, що утворюються в процесі радіоактивних перетворень. Переходячи в основний стан, вони випромінюють надлишок енергії у вигляді гамма-квантів. Особливий інтерес представляє варіант розпаду, коли радіоактивна ядро має великий час життя збудженого стану. В цьому випадку у знаходяться в різних енергетичних станах однакових ядер (з однаковими значеннями Z і A) спостерігаються однотипні радіоактивні розпади, але відбуваються вони з різними швидкостями, оскільки одні ядра розпадаються з порушеної, а інші з основного стану. Це явище отримало назву ядерної ізомерії, а порушена і нормальне ядра називаються ізомерами.
Радіоактивні ряди. Правило зміщення дозволило простежити перетворення природних радіоактивних елементів і вибудувати з них три генеалогічних дерева, родоначальниками яких є уран-238, уран-235 і торій-232. Кожне сімейство починається з надзвичайно долгоживущего радіоактивного елемента. Уранове сімейство, наприклад, очолює уран з масовим числом 238 і періодом напіврозпаду 4,5 * 10 9 років (в табл. 1 у відповідності з початковим назвою позначений як уран I).
Таблиця 1.
РАДІОАКТИВНЕ РОДИНА УРАНА
Період напіврозпаду. Найважливішою характеристикою радіоактивного атома є його час життя. Відповідно до закону радіоактивного розпаду, ймовірність того, що за даний проміжок часу відбудеться розпад одного атома, є величина постійна. Отже, число щомиті відбуваються розпадів пропорційно кількості наявних атомів, а закон, що описує процес розпаду, має експонентний характер. Якщо за час Т розпадається половина початкової кількості радіоактивних атомів, то половина залишилися атомів розпадеться протягом наступного проміжку часу тієї ж тривалості. Час Т називається періодом напіврозпаду радіоактивного елемента. Для різних елементів період напіврозпаду становить від десятків мільярдів років до мільйонних часток секунди і менше.
Сімейство урану. На елементах сімейства урану можна простежити більшість обговорювали вище властивостей радіоактивних перетворень. Так, наприклад, у третього члена сімейства спостерігається ядерна ізомерія. Уран X2, випускаючи бета-частинки, перетворюється в уран II (T = 1,14 хв). Це відповідає бета-розпаду збудженого стану протактиния-234. Однак в 0,12% випадків збуджений протактиний-234 (уран X2) випромінює гамма-квант і переходить в основний стан (уран Z). Бета-розпад урану Z, також призводить до утворення урану II, відбувається за 6,7 год. Радій З цікавий тим, що може розпадатися двома шляхами: випускаючи або альфа-, або бета-частинку. Ці процеси конкурують між собою, але в 99,96% випадків відбувається бета-розпад з утворенням радію С ". В 0,04% випадків радій С випускає альфа-частинку і перетворюється в радій С" (RaC "). У свою чергу RaC 'і RaC "шляхом емісії альфа- і бета-частинок відповідно перетворюються в радій D. Ізотопи. Серед членів уранового сімейства зустрічаються такі, атоми яких мають однаковий атомний номер (однаковий заряд ядер) і різні масові числа. Вони ідентичні за хімічними властивостями, але розрізняються за характером радіоактивності. Наприклад, радій B, радій D і радій G, що мають однаковий зі свинцем атомний номер 82, подібні до свинцю за хімічним поведінки. Очевидно, що хімічні властивості не залежать від масового числа; вони визначаються будовою електронних оболонок атома (отже, і Z). З іншого боку, масове число має вирішальне значення для ядерної стабільності радіоактивних властивостей атома. Атоми з однаковим атомним номером і різними масовими числами називаються ізотопами. Ізотопи радіоактивних елементів були відкриті Ф. Содді в 1913, але незабаром Ф.Астон за допомогою мас-спектроскопії довів, що ізотопи є і у багатьох стабільних елементів.
Інші природні радіоактивні елементи. Всі елементи, розташовані в періодичній таблиці за вісмутом (тобто з Z> 83), є радіоактивними. Подібно урану-238, довгоживучі уран-235 і торій-232 очолюють відповідно актініевое і торієве радіоактивні сімейства. У природних умовах зустрічаються уран, торій і їх дочірні радіоактивні продукти. Це обумовлено тим, що періоди напіврозпаду у родоначальників родин можна порівняти з віком Землі, і вони поки що не розпалися повністю. Хімічні елементи з атомним номером> 92 отримані в лабораторіях в результаті ядерних реакцій і виявлені серед продуктів термоядерних вибухів, причому всі вони виявилися радіоактивними. Серед більш легких елементів лише деякі володіють природною радіоактивністю. Періоди напіврозпаду у них настільки великі, що вони досі існують на Землі в помітних кількостях. Радіоактивний калій-40, випускаючи бета-частинки, перетворюється в стабільний кальцій-40 (T РАДІОАКТІВНОСТЬ10 9 років). Однак він може розпадатися і шляхом захоплення електрона, перетворюючись в аргон-40. Бета-активний рубідій-87, розпадаючись (T РАДІОАКТІВНОСТЬ6 * 10 10 років), переходить в стабільний стронцій-87. Зустрічається в природі самарій-152 - єдиний більш легкий, ніж вісмут, радіоактивний елемент, що випускає альфа-частинки. Його період напіврозпаду - 10 12 років. У елементів з атомними номерами 43, 61, 85 і 87 немає ні стабільних ізотопів, ні довгоживучих попередників, тому на Землі вони не виявлені. У самого долгоживущего ізотопу технецію (Z = 43) період напіврозпаду - близько 300 000 років, що значно менше передбачуваного віку Всесвіту. Однак значна кількість техніці виявлено в складі зірок спектрального класу S. Цей факт інтерпретується як явний доказ того, що в них порівняно недавно відбувалися активні еволюційні процеси.
Штучна радіоактивність. Бомбардуючи альфа-частками атоми газоподібного азоту, Е. Резерфорд і Дж. Чедвік в 1919 вперше здійснили ядерну реакцію, викликавши перетворення азоту в кисень. З появою прискорювачів заряджених частинок фронт робіт по вивченню ядерних реакцій значно розширився. У 1934 Фредерік і Ірен Жоліо-Кюрі відкрили явище штучної радіоактивності і позитронний тип розпаду. Вони виявили, що опромінені альфа-частками бор, магній і алюміній перетворюються в радіоактивні ізотопи інших елементів, розпад яких супроводжується випусканням позитрона (e +). Так, наприклад, при бомбардуванні альфа-частками алюмінію утворюється радіоактивний фосфор-30, який, розпадаючись (T = 2,5 хв), випускає e + і перетворюється в стабільний кремній-30. Позитрон, відкритий в 1932 К.Андерсон в створюваному космічними променями вторинному випромінюванні, являє собою частку, за масою і величиною заряду ідентичну електрону, але має позитивний електричний заряд (античастинка електрона). При випущенні позитрона ядром радіоактивного атома порядковий номер атома зменшується на одиницю, а масове число залишається без змін.
Електронний захоплення. Захоплення ядром одного з орбітальних електронів еквівалентний випускання позитрона: масове число атома при цьому не змінюється, а заряд ядра зменшується на одиницю. Електрони K і L оболонок знаходяться так близько до ядра, що в деяких випадках захоплення електрона, як механізм радіоактивного розпаду, починає конкурувати з випусканням позитрона. Оскільки для захоплення електрона потрібно менше енергії, ніж для еквівалентного позитронного розпаду, то іноді, як, наприклад, в разі берилію-7 (див. Табл. 2), енергетично можливий тільки електронний захоплення.
Таблиця 2.
Властивості ДЕЯКИХ ЛЕГКИХ АТОМІВ
Характеристики найлегших стабільних і радіоактивних атомів представлені в табл. 2, де Z - атомний номер, А - масове число. Наведена в таблиці атомна маса виражена в вуглецевих одиницях. В енергетичній шкалі вона дорівнює 931,162 МеВ. Атомна маса характеризує стабільність атома. Якщо два атома мають однакові масові числа і різні атомні номери (ізобари), то важчий изобар буде нестабільний щодо радіоактивного розпаду в більш легкий. Так, тритій-3 перетворюється в гелій-3, вуглець-11 - в бор-11.
Застосування радіоактивності.
Медицина. Радій та інші природні радіоізотопи широко застосовуються для діагностики і променевої терапії ракових захворювань. Використання для цієї мети штучних радіоізотопів значно підвищило ефективність лікування. Наприклад, радіоактивний йод, введений в організм у вигляді розчину йодиду натрію, селективно накопичується в щитовидній залозі і тому застосовується в в клінічній практиці для визначення порушень функції щитовидної залози і при лікуванні базедової хвороби. За допомогою міченого по натрію фізіологічного розчину вимірюється швидкість кровообігу і визначається прохідність кровоносних судин кінцівок. Радіоактивний фосфор застосовується для вимірювання об'єму крові і лікування еритремі.
Наукові дослідження. Радіоактивні мітки, в микроколичествах введені в фізичні або хімічні системи, дозволяють стежити за всіма відбуваються в них змінами. Наприклад, вирощуючи рослини в атмосфері радіоактивного діоксиду вуглецю, хіміки змогли зрозуміти тонкі деталі процесу освіти в рослинах складних вуглеводів з діоксиду вуглецю і води. В результаті безперервного бомбардування земної атмосфери космічними променями з високою енергією що знаходиться в ній азот-14, захоплюючи нейтрони і випускаючи протони, перетворюється в радіоактивний вуглець-14. Вважаючи, що інтенсивність бомбардування і, отже, рівноважний кількість вуглецю-14 в останні тисячоліття залишалися незмінними і з огляду на період напіврозпаду C-14 по його залишкової активності, можна визначати вік знайдених залишків тварин і рослин (радіовуглецевий метод). Цим методом вдалося з великою вірогідністю датувати виявлені стоянки доісторичної людини, що існували більше 25 000 років тому.
Див. також
Атома Будова;
Кюрі П'єр;
Радіовуглецеве Датування.
ЛІТЕРАТУРА
Вчення про радіоактивність. Історія і сучасність. М. 1973 Ядерні випромінювання в науці і техніці. М. 1984 Фурман В. І. Альфа-розпад і родинні ядерні реакції. М. 1985
Допомога пошукових систем