Сімейство мономерних рецепторів
Такі Рц близькі до Рц хемокинов і могли б допомагати вірусу вислизати від дії імунної системи господаря за рахунок молекулярної мімікрії білків, що беруть участь в реалізації захисних функцій. Рц, який кодується вірусом герпесу, асоційованим з саркомою Капоші, володіє конститувною активністю щодо Gq, що, зокрема, веде до індукції експресії фактора росту ендотелію судин і ангіогенезу в пухлині.
Рецепторні тирозинкінази поділяють на 2 сімейства, що розрізняються по структурної організації.
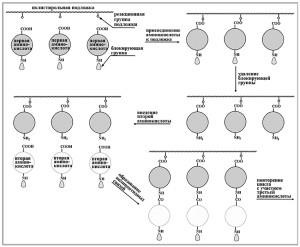
Проведення сигналу мономірними тирозинкіназ
Зв'язування лігандів Рц, що містять Ig-структури, може регулюватися протеогликанами.
У типовому варіанті зв'язування ліганда викликає димеризуется-цію Рц, що супроводжується взаємними фосфорилуванням внутрішньоклітинних доменів РЄ димера. Це має, як мінімум, два наслідки: 1) підвищення ферментативної активності кіназного доменів і 2) створення сайтів зв'язування білків, котрі дізнаються короткі амінокислотні мотиви, що містять фосфотірозіл. Функцію такого впізнавання виконують спеціалізовані домени білків, найбільш поширеним з яких є домен SH2 (домен гомології 2 з внутрішньоклітинної тирозинкінази src), що складається приблизно з 100 А.К. залишків. Зв'язуються з фосфорілірованним Рц білки можуть ставати його субстратами, тобто піддаються фосфорилированию. Якщо даний асоційований з Рц білок є ферментом, то фосфорилирование змінює (підвищує) його ферментативну активність. Якщо асоційований білок є адаптером, то його фосфорилювання забезпечує опосередковане взаємодія з Рц третього білка, який або за рахунок фосфорилювання Рц, або за рахунок зміни своєї конформації при зв'язуванні може змінювати свою активність. Зв'язування Рц і ферментативних, і адапторних білків веде до зміни їх внутрішньоклітинної локалізації, наближаючи до місця реалізації їх активності.
Автофосфорилювання Туг857 має значення для підвищення ферментативної активності Рц. З фосфорілірованним Рц сайт-специфічно взаємодіє ряд 8Н2-містять білків - фосфоліпаза С-у (PLC-y), регуляторна РЄ (Р85) фосфатидилинозитол З'-кінази (РІЗК); білок GAP, який активує ГТФазу Ras; 3 члени сімейства тирозинкіназ Src (pp60c-src, p59fyn, pp62c-yes), протеінтірозінфосфатаза-2 (SHP-2).
рецепторная молекула
Домени SH2 дізнаються послідовності з консенсусом Y (P) XNX. Ряд інших білків (адаптерів), що містять SH2 домени, (наприклад, що трансформує білок, що містить домен 2 гомології з Src, She), може зв'язуватися з декількома фосфорильованій сайтами Рц, тобто щодо неспецифічно [She містить ще один довідався містять фосфотірозінов послідовності з консенсусом NPXY (P) домен, РТВ]. Деякі БШ-содержашийся білки включають ще одну область гомології (SH3), також бере участь в міжбілкового взаємодіях (SH3 дізнається містять пролін мотиви). Це дозволяє Адапторная білкам виконувати функцію містків між Рц або асоційованими з ним білками і нижележащими елементами системи проведення сигналу. Наприклад, білок 2, що зв'язує Рц чинників зростання (Grb2), може зв'язуватися безпосередньо з Рц або з асоційованими з Рц Р85 РЄ PI3K, SHP-2 або She, причому домени Grb2, залучені в ці взаємодії, можуть відрізнятися. Нижче приведена доменна організація деяких адапторних білків.
Відзначимо, що рецепторна молекула не може рівноцінно взаємодіяти одночасно з усіма ферментативними і адап-Торна білками, що володіють спорідненістю до Рц. Так, зв'язування з Рц PLCy або Ras-GAP знижує здатність PDGFRp активувати PI3K. Адапторная білки беруть участь не тільки в проведенні сигналу даними Рц, але і пов'язують між собою системи проведення сигналів Рц різних типів. Наприклад, Адапторная білок Nck2 (non-catalytic region of tyrosine kinase - білок, що містить некаталітичні область тирозинкінази) взаємодіє одночасно з рецепторними тирозинкіназ і іншим Адапторная білком - PINCH (particularly interesting new Cys-His protein) - «особливо цікавий новий Cys-His білок »), який в свою чергу утворює комплекс зі пов'язаної з інтегринами протеїнкіназою ILK (integrin-linked protein kinase), яка бере участь в проведенні сигналу Рц клітинної адгезії інтегринами.
функції ферментів
PINCH також взаємодіє з білками групи DOCK (dedicator of cytokinesis protein - призначений для цітокінеза), які беруть участь у змінах поверхні клітин при їх адгезії. Рц-тирозинкінази можуть взаємодіяти з білками групи DOCK і більш прямим способом - через Адапторная білки Nek і Crk (в зв'язуванні DOCK беруть участь SH3 домени адаптерів). Таким чином, Адапторная білки формують складні мережі взаємодій різних сигнальних систем.
Нижче розглянуті функції ферментів, асоційованих з активованим PDGFRp \ Ras-GAP (білок 1, що активує ГТФазу Ras) поряд з SH2 доменами містить кілька інших функціональних доменів - SH3, домен гомології з плекстріном (РН); домен залежного від кальцію зв'язування ліпідів (С2); домен, який активує ГТФазную активність Ras (Ras-GAP).
Всупереч своїй назві, GAP НЕ активує, а пригнічує Ras за рахунок прискорення гідролізу пов'язаного з Ras ГТФ (тобто GAP активує ГТФазную активність Ras) за участю С-кінцевого домену GAP. Тим самим рекрутування GAP фосфорілірованним Рц-тирозинкінази веде до пригнічення сигнального шляху Ras - "МАРК. Мутації в домені SH2 GAP, за допомогою якого цей білок взаємодіє з Рц, можуть вести до злоякісного переродження клітин. Крім Ras, GAP може взаємодіяти з рядом інших білків і регулювати їх активність. Так, взаємодія з GAP ендорібонуклеаза G3BP може впливати на швидкість дефосфорилирования останньої і тим самим - на інтенсивність деградації РНК в клітині. Встановлено також, що GAP служить не тільки регулятором Ras, а й його ефектором. Один з можливих механізмів даного шляху полягає у взаємодії домену SH3 GAP з кіназного доменом серин / треонінкіназ групи Аврора, що призводить до пригнічення ферментативної активності останніх (кінази групи Аврора беруть участь в завершенні митотического циклу).
Освіта двох друге посередників гормонального дії
Домени РН і С2 GAP беруть участь в інгібуванні проліферації клітин.
PLCy (фосфолипаза Су) грає важливу роль в проведенні сигналів декількох класів Рц, включаючи Рц-тирозинкінази. Каталізує утворення двох друге посередників гормонального дії - діацілгліцерола (DAG) і інозитол-1,4,5-трифосфату (IP3) шляхом гідролізу фосфатидилинозитол-4,5-біфосфату.
Каталітична активність ферменту, що визначається доменами X і Y, підвищується в результаті фосфорилювання Рц-тирозинкінази. Фосфорилювати і активувати PLCy здатні і нерецепторние тирозинкінази, включаючи кінази групи Src, що активуються рецепторними тирозинкіназ. Інші домени ферменту можуть брати участь в міжбілкового взаємодіях, що визначають інші шляхи проведення сигналу за участю PLCy. Так, показано зв'язування PLCy через домени SH2 і SH3 з білком р115, які беруть участь у внутрішньоклітинному транспорті і злиття з мембраною секреторних пухирців. SH3 домен ферменту за допомогою невідомого поки механізму забезпечує гормональну стимуляцію входження кальцію в клітини. Істотно, що для цієї стимуляції ферментативна активність PLCy не потрібно. З доменом РН PLCy здатний взаємодіяти фосфатидилинозитол-3,4,5-трифосфат (Р1-3,4,5-Р3) - продукт каталітичної активності ще одного асоційованого з тірозінкіназная Рц ферменту - PI3K. Ця взаємодія стимулює переміщення PLCy в головний зону мігруючої клітини, де фермент, як передбачається, модулює полімеризацію актину.
Src - сімейство цитоплазматических протоонкогенах тирозинкіназ. N-кінець модифікований міристат, що забезпечує заякоріванню в плазматичній мембрані. Найбільш широко експресуються src, fyn, yes.