Історична довідка. У 1778 К. Шеєле, нагріваючи графіт з селітрою, виявив, що при цьому, як і при нагріванні вугілля з селітрою, виділяється вуглекислий газ. Хімічний склад алмаза був встановлений в результаті дослідів А. Лавуазьє (1772) з вивчення горіння алмаза на повітрі і досліджень С. Теннанта (1797), який довів, що однакові кількості алмаза і вугілля дають при окисленні рівні кількості вуглекислого газу. Вуглець був визнаний хімічним елементом в 1789 Лавуазьє. Латинська назва «carboneum» вуглець отримав від «carbo» - вугілля. А в 1961 Міжнародні союзи теоретичної і прикладної хімії (ІЮПАК) і з фізики взяли за одиницю атомної маси масу ізотопу вуглецю 12C, скасувавши що існувала до того кисневу шкалу атомних мас. Атомна маса вуглецю в цій системі дорівнює 12,011, так як вона є середньою для трьох природних ізотопів вуглецю з урахуванням їх поширеності в природі.
Вуглець відомий з давніх-давен. З давніх-давен відомо, що графітом можна маркувати інший матеріал, і сама назва «графіт», що походить від грецького слова, що означає «писати», запропоновано А.Вернера в 1789. Однак історія графіту заплутана, часто за нього брали речовини, що володіють подібними зовнішніми фізичними властивостями , наприклад молибденит (сульфід молібдену), у свій час вважався графітом. Серед інших назв графіту відомі «чорний свинець», «карбідне залізо», «сріблястий свинець». У 1779 К. Шеєле встановив, що графіт можна окислити повітрям з утворенням вуглекислого газу.
Алмази вперше знайшли застосування в Індії, а в Бразилії дорогоцінні камені придбали комерційне значення в 1725; родовища в Південній Африці були відкриті в 1867. У XX столітті основними виробниками алмазів є ПАР, Заїр, Ботсвана, Намібія, Ангола, Сьєрра-Леоне, Танзанія і Росія. Штучні алмази, технологія яких була створена в 1970, виробляються для промислових цілей.
Фізичні та хімічні властивості. Відомі чотири кристалічні модифікації вуглецю: графіт, алмаз, карбін і лонсдейліт. Графіт - сіро-чорна, непрозора, жирна на дотик, луската, дуже м'яка маса з металевим блиском, має електропровідністю. Атоми розташовані паралельними шарами, утворюючи гексагональну решітку. Усередині шару атоми пов'язані сильніше, ніж один шар з іншим, тому графіт може розшаровуватися. Згорає при 700єС в рісутствіі кисню. Зустрічається в природі; виходить штучно. При високій температурі, тиску і рісутствіі каталізатора (марганець Mn, хром Cr, платинові метали) графіт перетворюється на алмаз. Алмаз - мінерал, що має жовтуватий, білий, сірий, зелений, рідше блакитний і чорний колір. Чи не проводить електричний струм, погано проводить тепло. У кристалі атоми вуглецю утворюють безперервний тривимірний каркас, що складається з зчленованих тетраедрів, що забезпечує високу міцність зв'язків. Алмаз - це найтвердіша речовина з усіх відомих. Температура плавлення вище 3500єС. Хімічно стійкий. Згорає при 870єС в присутності кисню. При 1800єС за відсутності кисню перетворюється в графіт. Прозорі кристали; після обробки - діаманти. Видобувають з розсипів і корінних родовищ. Синтетичний алмаз отримують з графіту при високих тиску і температурі. Він частіше напівпрозорий або непрозорий; має кристалічну структуру і властивості природного алмаза.Жідкій карбон може бути отриманий при тиску вище 10,5 Мн / мІ (105 кгс / СМІ) і температурах вище 3700єС. Кокс, сажа, деревне вугілля (твердий вуглець) мають ту ж будову, що і графіт.Для твердого вуглецю характерно також стан з неврегульованою структурою - так званий «аморфний» вуглець. яка не є самостійною модифікацією; в основі його будови лежить структура мелкокристаллического графіту. Нагрівання деяких різновидів «аморфного» вуглецю вище 1500-1600єС без доступу повітря викликає їх перетворення в графіт. Фізичні властивості «аморфного» вуглецю дуже сильно залежать від дисперсності частинок і наявності домішок. Щільність, теплоємність, теплопровідність і електропровідність «аморфного» вуглецю завжди вище, ніж графіту. Карбин отриманий штучно. Він являє собою дрібнокристалічний порошок чорного кольору (щільність = 2 г / смі). Побудований з довгих ланцюжків атомів С, укладених паралельно один одному. Лонсдейліт знайдений в метеоритах і отриманий штучно; його структура і властивості остаточно не встановлені.
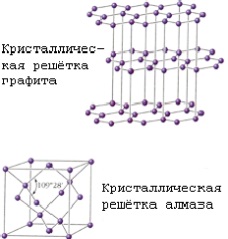
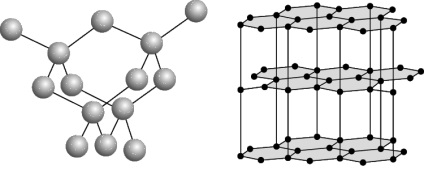
Структура алмазу (а) і графіту (б).
Конфігурація зовнішньої електронної оболонки атома углерода2sІ2pІ. Для карбону характерне утворення чотирьох ковалентних зв'язків, обумовлене збудженням зовнішньої електронної оболонки до стану 2spі. Хімічна зв'язок може здійснюватися за рахунок sp3 -, sp2 - і sp - гібридних орбіталей, яким відповідають координаційні числа 4, 3 і 2. Число валентних електронів карбону і число валентних орбіталей однаково; це одна з причин стійкості зв'язку між атомами вуглецю.
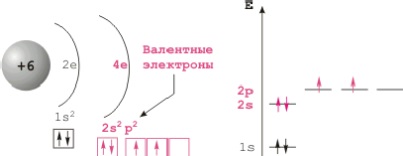
Будова атома вуглецю.
Унікальна здатність атомів вуглецю з'єднуватися між собою з утворенням міцних і довгих ланцюгів і циклів призвела до виникнення величезного числа різноманітних з'єднань вуглецю (вуглеводнів), що вивчаються органічною хімією.
У з'єднаннях вуглець виявляє ступеня окислення -4; +2; +4. Атомний радіус 0,77Б, ковалентні радіуси 0,77Б, 0,67Б, 0,60Б відповідно в одинарному, подвійному і потрійному зв'язках; іонної радіус
С4 2,60Б, С4 + 0,20Б. При звичайних умовах карбон хімічно інертний, при високих температурах він сполучається з багатьма елементами, виявляючи сильні відновні властивості. Хімічна активність зменшується в ряді: «аморфний» вуглець, графіт, алмаз; взаємодія з киснем повітря (горіння) відбувається відповідно при температурах вище 300-500єС, 600-700єС і 850-1000єС з утворенням двоокису вуглецю CO2 і окису вуглецю CO.
Ізотопи вуглецю. У природі відомо сім ізотопів вуглецю, з яких істотну роль грають три. Два з них - і - є стабільними, а один - - радіоактивним (в організмі людини його міститься близько 0,1 мккюри). З використанням ізотопів вуглецю в біологічних і медичних дослідженнях пов'язані багато великих досягнень у вивченні обміну речовин і кругообігу вуглецю в природі. Так, за допомогою радіовуглецевого мітки була доведена можливість фіксації Н14СО3 рослинами і тканинами тварин, встановлена послідовність реакції фотосинтезу, вивчений обмін амінокислот, простежені шляхи біосинтезу багатьох біологічно активних сполук і т. Д. Застосування 14С сприяло успіхам молекулярної біології у вивченні механізмів біосинтезу білка і передачі спадкової інформації. Визначення питомої активності 14С в вуглецевмісних органічних залишках дозволяє судити про їх вік, що використовується в палеонтології і археології.
Вуглець в організмі. Вуглець - найважливіший біогенний елемент, що становить основу життя на Землі, структурна одиниця величезного числа органічних сполук, що беруть участь в побудові організмів і забезпеченні їх життєдіяльності (біополімери, а також численні низькомолекулярні біологічно активні речовини - вітаміни, гормони, медіатори та ін.). Значна частина необхідної організмам енергії утворюється в клітинах за рахунок окислення вуглецю. Виникнення життя на Землі розглядається в сучасній науці як складний процес еволюції вуглецевих сполук.
Роль вуглецю в живій природі. Унікальна роль карбону в живій природі зумовлена його властивостями, якими в сукупності не володіє жоден інший елемент періодичної системи. Між атомами вуглецю, а також між вуглецем і іншими елементами утворюються міцні хімічні зв'язки, які, однак, можуть бути розірвані в порівняно м'яких фізіологічних умовах (ці зв'язки можуть бути одинарними, подвійними і потрійними). Здатність вуглецю утворювати 4 рівнозначні валентні зв'язки з іншими атомами вуглецю створює можливість для побудови вуглецевих скелетів різних типів - лінійних, розгалужених, циклічних. Показово, що всього три елемента - вуглець С, кисень О і водень Н - становлять 98% загальної маси живих організмів. Цим досягається певна економічність в живій природі: при практично безмежній структурній різноманітності вуглецевих сполук невелике число типів хімічних зв'язків дозволяє набагато скоротити кількість ферментів, необхідних для розщеплення і синтезу органічних речовин. Особливості будови атома вуглецю лежать в основі різних видів ізомерії органічних сполук (здатність до оптичної ізомерії виявилася вирішальною в біохімічній еволюції амінокислот, вуглеводів і деяких алкалоїдів).
Згідно із загальноприйнятою гіпотезою А. І. Опаріна, перші органічні сполуки на Землі мали абиогенное походження. Джерелами вуглецю служили метан (CH4) і ціаністий водень (HCN), що містилися в первинній атмосфері Землі. З виникненням життя єдиним джерелом неорганічного вуглецю, за рахунок якого утворюється вся органічна речовина біосфери, є двоокис вуглецю (CO2), що знаходиться в атмосфері, а також розчинена в природних водах у вигляді HCO-3. Найбільш потужний механізм засвоєння (асиміляції) вуглецю (у формі CO2) - фотосинтез - здійснюється повсюдно зеленими рослинами (щорічно асимілюється близько 100 млрд. Т CO2). На Землі існує і еволюційне більш древній спосіб засвоєння CO2 шляхом хемосинтезу; в цьому випадку мікроорганізми-хемосинтетики використовують не променисту енергію Сонця, а енергію окислення неорганічних сполук. Більшість тварин споживають вуглець з їжею у вигляді вже готових органічних сполук. Залежно від способу засвоєння органічних сполук прийнято розрізнювати автотрофні організми і гетеротрофні організми. Застосування для біосинтезу білка та інших поживних речовин мікроорганізмів, що використовують як єдине джерело вуглецю вуглеводні нафти, - одна з важливих сучасних науково-технічних проблем.
Крім основної функції - джерела вуглецю - двоокис вуглецю CO2, розчинена в природних водах і в біологічних рідинах, бере участь у підтримці оптимальної для життєвих процесів кислотності середовища. У складі CaCO3 вуглець утворює зовнішній скелет багатьох безхребетних (наприклад, раковини молюсків), а також міститься в коралах, яєчній шкаралупі птахів і ін. Такі сполуки вуглецю, як HCN, CO, CCl4, що переважали в первинній атмосфері Землі в добіологічних період, надалі , в процесі біологічної еволюції, перетворилися на сильних антіметаболіти обміну речовин.
Кругообіг вуглецю. Вуглець - основний біогенний елемент; він грає найважливішу роль в утворенні живої речовини біосфери. Вуглекислий газ з атмосфери в процесі фотосинтезу, здійснюваного зеленими рослинами, асимілюється і перетворюється в різноманітні й численні органічні сполуки рослин. Рослинні організми, особливо нижчі мікроорганізми, морський фітопланктон, завдяки винятковій швидкості розмноження продукують в рік близько 1,5 · 10№№ т вуглецю у вигляді органічної маси, що відповідає
5,86 · 10Іє Дж (1,4 · 10Ієкал) енергії. Рослини частково поїдаються тваринами (при цьому утворюються більш-менш складні харчові ланцюги). В остаточному підсумку органічна речовина в результаті дихання організмів, розкладання їх трупів, процесів бродіння, гниття і горіння перетворюється на вуглекислий газ або відкладається у вигляді сапропелю, гумусу, торфу, які, в свою чергу, дають початок багатьом ін. Каустобиолитам - кам'яним вугіллям, нафти, пальним газам.
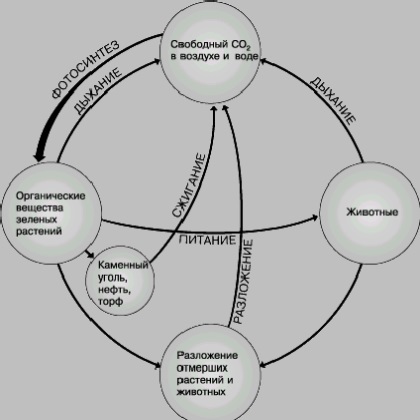
У процесах розпаду органічних речовин, їх мінералізації величезну роль грають бактерії (наприклад, гнильні), а також багато гриби (наприклад, плісняви).
В активному круговороті вуглецю бере участь дуже невелика частина всієї його маси. Величезна кількість вугільної кислоти законсервовано у вигляді викопних вапняків та інших порід. Між вуглекислим газом атмосфери і водою океану, в свою чергу, існує рухлива рівновага.
У т В г на 1 см І поверхні Землі
Тварини 5 · 109 0,0015
Рослини 5 · 10№№ 0,1
Атмосфера 6,4 · 10№№ 0,125