Завдання 2. Покажіть розподіл електронної щільно-
сти в молекулах наступних сполук: а) 1-пропанол; б) етілборан; в) 2-метілпропеналь; г) 1-бутен; д) 3,3,3- тріхлорпропен; е) ізопропіллітій; ж) 2-метокси-1-бутен; з) 1-нітро-1-бутен.
У молекулах, що не містять полярних зв'язків, електронна щільність рівномірно розподілена між атомами. Якщо ж в молекулі хоча б одна зв'язок є полярною, диполь зв'язку з цим викликає електронні зміщення в інших зв'язках. Зміщення електронної щільності можуть викликатися дією або індуктивного ефекту заступника, або - в разі наявності сполучення орбіталей - мезомерного ефекту.
Індуктивний ефект - це з мещение електронної щільності зв'язку, що викликається сусідній полярної зв'язком. Його позначають буквою I. Індуктивний ефект зв'язку С-Н довільно прийнятий рівним нулю. Якщо заступник, викликає зсув електронів зв'язку, притягує до себе електрони сильніше, ніж атом водню, йому приписують негативний індуктивний ефект (-I). В іншому випадку, коли заступник відштовхує від себе електронну щільність сильніше, ніж атом водню, індуктивний ефект позитивний (+ I).
Мезомерний ефект - це здатність заступника вступати в орбітальна взаємодія з сусідньої кратної зв'язком. Заступники, які надають для взаємодії р-електрони у вигляді неподіленої пари (р, π- сполучення), тобто сприяють зсуву електронної щільності в напрямі сусідній кратного зв'язку, проявляють + М- ефект. Заступники, які мають полярну кратну зв'язок, вступають в π, π-взаємодія (π, π-спряження) з кратною зв'язком, відокремленої від неї однієї простої зв'язком, і зміщують електронну щільність на себе. Вони мають -М-ефектом.
Поляризацію і полярних зв'язків, і поляризованих в результаті індуктивних і мезомерного ефектів зв'язків вказують частковими зарядами (δ- і δ +) на відповідних атомах. Крім того, для простих зв'язків використовують стрілки уздовж зв'язків, а для кратних зв'язків - вигнуті стрілки від зв'язку до відповідного атому (або до простої зв'язку, що розділяє пов'язані кратні зв'язку).
Завдання 3. Порівняйте швидкості реакцій електрофільного
приєднання до наступних сполук: етилен, пропен, 3,3,3-тріфторпропен, 2-метилпропіл.
Швидкість реакцій електрофільного приєднання до подвійний вуглець-вуглецевого зв'язку, або реакційна здатність в реакціях Аd Е. залежить від нуклеофильности зв'язку з цим. Нуклеофільність, тобто здатність бути донором електронної пари, в свою чергу, пропорційна величині електронної щільності на зв'язку з цим. Тому для порівняння швидкостей необхідно порівняти вплив заступників (атомів і груп атомів) на електронну щільність подвійний зв'язку, тобто визначити напрямок і відносну величину їх електронних ефектів.
CH 2 CH 2 CH 3 CH CH 2 CH 2 CHCF CH 3 C CH 2
У молекулі етилену з атомами вуглецю подвійний зв'язку пов'язані тільки атоми водню, індуктивний ефект яких прийнято рівним 0. Тому молекулу етилену можна розглядати як стандарт, щодо якого можна розташовувати
в ряд всі інші з'єднання.
У молекулі пропена метильная група проявляє + I-
ефект, тобто є заступником, яке підвищує електронну щільність на подвійному зв'язку і, отже, підвищує реакційну здатність пропена в реакціях електрофільного приєднання в порівнянні з реакційною здатністю етилену.
Ще більш реакционноспособним, ніж етилен і пропен, є 2-метилпропіл. оскільки в його молекулі подвійний зв'язок має два електронодонорні заступника.
У молекулі 3,3,3-тріфторпропена три атома фтору через їх більшої електронегативності порівняно з атомом вуглецю проявляють -I-ефекти, які викликають на атомі вуглецю, з яким вони пов'язані великий дефіцит електронної щільності. Це робить тріфторметільную групу сильним електроноакцептором. Тому 3,3,3-тріфторпропен дезактивірован до реакцій електрофільного приєднання, тобто реа-
гірует з електрофільними реагентами значно повільніше, ніж етилен.
Таким чином, дані з'єднання можна розташувати в такий ряд по збільшенню реакційної здатності в реакціях
3,3,3-тріфторпропен <етилен <пропен <2 метилпропіл.
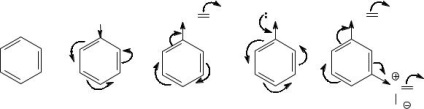
Завдання 4. Порівняйте реакційну здатність наступних
з'єднань в реакціях електрофільного заміщення: бензол, толуол, бензальдегід, фенол, мета - нітробензальдегід.
Реакційна здатність ароматичних сполук в реакціях електрофільного заміщення залежить від їх нуклеофильности - здатності бути донором електронної пари, яка залежить від загальної електронної щільності ароматичного ядра. Заступники, оказивющіе електронодонорності дію на ароматичне ядро, збільшують електронну щільність на ньому і тим самим підвищують реакційну здатність сполук, тобто активують їх до електрофільної атаці. Електроноакцепторні заступники, зменшуючи електронну щільність ароматичного кільця, діють як дезактивирующие заступники. Тому для порівняння реакційної здатності необхідно визначити характер заступників, виявити всі електронні ефекти, якими конкретний заступник впливає на ароматичне ядро.
У молекулі толуолу метильний заступник проявляє + I-ефект, тобто є електронодонором. Тому толуол в порівнянні з бензолом є активованим з'єднанням і реагує з електрофілами швидше.
Молекула бензальдегида дезактивована до електрофільні заміщення, оскільки формільная група є електроноакцепторні заступником (дезактиватори), проявляючи по відношенню до бензольного кільця і -I-, і -М-ефект.
Ще більш дезактивованим, ніж бензальдегід, є мета - нітробензальдегід. оскільки крім електроноакцепторні формільной групи в цій молекулі присутня ще й такий сильний дезактивирующий заступник, як нітрогрупа (-I- і -М-ефекти).
Самим активованим з'єднанням є фенол. гідроксильна група якого, незважаючи на -I-ефект, виявляє сильну загальне електронодонорності вплив на ароматичне ядро завдяки дуже ефективному р-π- сполученню (+ М >> - I).
Таким чином, дані з'єднання розміщуються в наступний ряд по зростанню реакційної здатності в реакціях електрофільного заміщення:
мета -нітробензальдегід <бензальдегід <бензол <толуол <фенол.
Завдання 5. Порівняйте кислотні властивості наступних соеди-
нений: а) метан і нитрометан; б) етанол і 2-хлоретанол; в) метанол і метиламін; г) оцтова кислота і ацетон; д) етанол і фенол. Відповіді обґрунтуйте.
Кислотні властивості відповідно до теорії Бренстеда проявляються в здатності з'єднання вступати в оборотне взаємодія з акцептором протонів - підставою - з утворенням сполученого підстави і сполученої основи кислоти і визначаються положенням цієї рівноваги. Чим сильніше рівновагу зміщений вправо, тим сильніше виражені кислотні властивості. Порівняти кислотні властивості різних кислот можна якісно, порівнюючи стан кислотно-основних рівноваг цих кислот з будь-яким підставою. Положення рівноваги залежить від відносної стабільності пов'язаних підстав, тому для порівняння кислотних властивостей різних з'єднань необхідно оцінити стійкість пов'язаних підстав. Чим більше стійко поєднане підставу,
тим воно слабкіше, і, отже, тим сильніше соответст-
чих кислота. На стійкість пов'язаних підстав, які для не мають заряду кислот є негативно зарядженими частинками - аніонами, впливають як внутрішньо-молекулярні фактори, так і зовнішні чинники, як, наприклад, сольватация. Якщо ж розчинник не вказано, то розглядають залежність стійкості пов'язаних підстав тільки від внутрішніх чинників, до яких належать насамперед електронні: а саме, здатність сусідніх атомів і груп стабілізувати негативно заряджену частинку. Це може бути негативний індуктивний ефект заступника, який зменшує негативний заряд за рахунок стягування електронної щільності, або негативний мезомерний ефект, що обумовлює делокалізацію електронної щільності і негативного заряду.
а) метан і нитрометан
Зобразимо кислотно-основні рівноваги для цих з'єднань з будь-яким підставою (В).
Отже, нітрометіл-аніон стабільніший, ніж метил-аніон. Тому нитрометан є сильнішою кислотою, ніж метан. Дійсно, нитрометан як кислота більш ніж на 30 порядків сильніше, ніж метан.
б) етанол і 2-хлоретанол
У молекулах етанолу і 2-хлоретанол є різні атоми водню, але кислотні властивості цих сполук обумовлені наявністю гідроксильної групи, оскільки О-Н-кислоти, є більш сильними, ніж С-Н-кислоти (здатність атомів нести негативний заряд залежить від їх положення в періодичної таблиці: в періоді вона збільшується зліва направо). Тому кислотно-основні рівноваги для цих сполук виглядають наступним чином:

CH 3 CH 2 O H + BCH 3 CH 2 O + B H
CH 2 CH 2 O H + BCH 2 CH 2 O + B H
2-Хлоретоксід-аніон більш стійкий, ніж етоксид-аніон, оскільки атом хлору, що виявляє -I-ефект, стягує електронну щільність по σ-зв'язків, зменшуючи електронну щільність на атомі кисню і цим послаблюючи його основність. Отже, 2-хлоретанол сильніша кислота, ніж етанол.
в) метанол і метиламін
О-Н-Кислоти, як і N-Н-кислоти є більш сильними кислотами, ніж С-Н-кислоти, тому кислотно-основні рівноваги для метанолу і метиламін виглядають наступним чином:
CH 3 NHH + BCH 3 NH + B H
Метоксид-аніон є більш стійкою часткою, ніж метиламід-аніон, оскільки більш електронегативний атом кисню легше «тримає» негативний заряд, ніж менш електронегативний атом азоту. Тому метоксіданіон є більш слабким зв'язаних підставою, ніж метиламід-аніон, а метанол - сильніша кислота, ніж метиламин.
г) оцтова кислота і ацетон
Кислотно-основні рівноваги для оцтової кислоти і ацетону виглядають наступним чином: