Наука про речовину ґрунтується на сучасних знаннях про атомах - найдрібніших частинках елементів і молекулах - найдрібніших частинках хімічних сполук. Атоми мають розмір близько 10
8 см (одного ангстрема). Великі молекули, що містять тисячі атомів, мають розмір близько 10
6 см. Характер руху молекул і атомів, їх взаємодія визначають, в якому агрегатному стані знаходиться речовина - в твердому, рідкому або газоподібному.
Молекули можуть здійснювати поступальний, обертальний і коливальний рух. Якщо речовина знаходиться в газоподібному або рідкому стані, то можливі всі три види цих рухів. Якщо ж речовина твердне, переважною формою руху молекул і атомів стають коливання.
При вивченні стану речовини прагнуть знайти взаємозв'язок між тиском. при якому знаходиться речовина, його щільністю і температурою. Якщо позначити тиск p. густина # 961 ;, а зворотну їй величину - питомий об'єм речовини V і температуру Т, то стан речовини буде характеризуватися співвідношенням р, V і Т або, як прийнято в термодинаміки, -Співвідношення. Найпростіше це співвідношення виглядає для стану речовини, при якому молекули здійснюють поступальний рух в період між зіткненнями між собою, а міжмолекулярні сили помітно не виявляються. Такий стан речовини характерно для досить розріджених газів. Речовина, що знаходиться в цьому стані, називають ідеальним газом. Для ідеальних газів відповідно до рівняння Клапейрона - Менделєєва
де - тиск, Па; - обсяг газу, м 3. - маса газу, кг; - газова постійна, Дж / (кг • К); - абсолютна температура, К.
Газова постійна чисельно дорівнює роботі розширення 1 кг ідеального газу в ізобаріческом процесі при збільшенні температури газу на 1 К.
При високому стисканні газу його параметри вже не будуть описуватися рівнянням стану ідеального газу. Ван-дер-Ваальса були введені в рівняння стану ідеального газу (2.27) поправки: величина b. враховує обсяг самих молекул, і величина a / v 2. враховує взаємодію між молекулами. В результаті було отримано рівняння стану «реального газу» (рівняння Ван-дер-Ваальса) в наступному вигляді:
Складність застосування рівняння (2.28) для практичних розрахунків полягає в тому, що в газонефтепромисловом справі зустрічаються, як правило, суміші газів, для яких рівняння Ван-дер-Ваальса можна застосувати насилу.
Гарне узгодження з експериментальними даними для газів, щільність яких не перевищує двох третин від щільності газу при критичних умовах, отримують за рівнянням Бітті-Бріджмена
де а, b, с, Ао і По - постійні для даних компонентів природного газу, які обчислюються на підставі експериментальних даних.
Коефіцієнт сверхсжімаемості. При великому числі компонентів розрахунки за наведеними формулами стають трудомісткими. Тому для розрахунку стану реальних газів зазвичай користуються узагальненим газовим законом у вигляді рівняння Клапейрона, в яке вводиться поправка (коефіцієнт сверхсжімаемості), що враховує відхилення реальних газів від законів стиснення і розширення ідеальних газів.
де z - коефіцієнт сверхсжімаемості; - маса газу в кг; р - тиск в Па; V-об'єм газу в м 3; R - газова постійна в Дж / (кг * град); Т - абсолютна температура в К.
Характер зміни коефіцієнта сверхсжімаемості z, який показує відношення обсягу реального газу до обсягу ідеального при одних і тих же умовах, зі зміною температури і тиску можна встановити, з огляду на відмінності реальних газів від ідеальних. В останніх молекули займають незначний обсяг (у порівнянні з обсягом газу) і не відчувають сил тяжіння один до одного. Молекули ж реальних газів мають певні розмірами, масою та взаємодіють один з одним. Тому реальний газ наближається до ідеальних при низькому тиску, коли число молекул в одиниці об'єму невелика. Отже, при низькому тиску величина коефіцієнта стисливості повинна бути близька до одиниці. З підвищенням тиску молекули газу зближуються і сили тяжіння між молекулами починають допомагати зовнішнім силам, стискає газ. Внаслідок цього реальні гази повинні стискатися сильніше, ніж при тих же умовах стискаються ідеальні гази. Отже, зі зростанням тиску коефіцієнт стисливості z повинен спочатку зменшуватися. Коли вуглеводневий газ стиснутий до такої міри, що він наближається за властивостями до рідин, міжмолекулярні відстані зменшуються настільки, що починають проявлятися взаімоотталківающіеся сили між молекулами, що перешкоджають подальшому зменшенню обсягу газу. У цих умовах вуглеводневий газ повинен стискатися менше, ніж при малих тисках, т. Е. Значення z знову зростають при збільшенні тиску.
З наближенням тиску і температури до їх критичних значень властивості газової та рідких фаз стають однаковими, поверхня розділу між ними зникає і щільності їх зрівнюються.
Критична температура (Ткр) - максимальна температура, при якій газ і рідина можуть ще співіснувати в рівновазі (табл. 2.4).
Критичний тиск - тиск парів речовини при критичній температурі (табл. 2.3), а обсяг речовини при даних Ткр і Pкр. віднесений до 1 молю або до одиниці маси речовини, називається критичним питомим об'ємом.
Пружність насичених парів вуглеводнів, це тиск, при якому газ починає конденсуватися і переходити в рідкий стан, підвищується з ростом температури і вона тим вище, чим нижче щільність вуглеводню.
Таблиця 2.4 Критичні тиску і температури компонентів нафтових газів
де р і Т - тиск і температура газу; рКрi і Tкрi - критичні тиск і абсолютна температура i-го компонента; = І - среднекрітіческіе (псевдокрітіческіе) абсолютна температура і тиск; уi - молярна концентрація i-го компонента в газі.
Таким чином, рпр і Tпр висловлюють тиск і абсолютну температуру в частках від відповідних критичних величин.
Різні гази, що мають однакові наведені температуру і тиск, знаходяться в «відповідних станах».
За принципом відповідних станів термодинамічні властивості речовин (в тому числі і коефіцієнти стисливості різних газів), що мають рівні
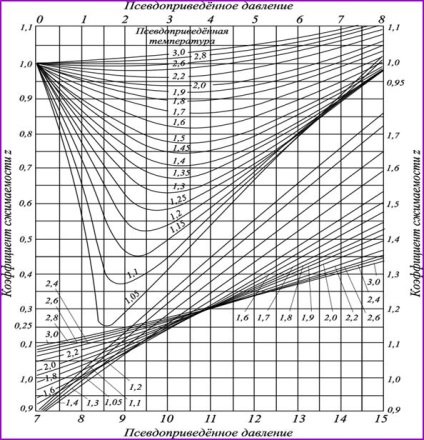
Мал. 2.10. Коефіцієнти сверхсжімаемості вуглеводневих газів,
в залежності від наведених параметрів
наведені температури і тиску, приблизно однакові, так як при цьому різні гази знаходяться як би в однаковому відносному наближенні до рідкого стану. Тому графіки коефіцієнта сверхсжімаемості z, в наведених координатах для вуглеводнів одного гомологічного ряду збігаються з точністю, достатньою для практики. На цій підставі графік (рис. 2.10) може бути використаний для обчислення питомої обсягу та інших параметрів будь-якого газу (в тому числі і газових сумішей), якщо відомі його критичні параметри (табл.2.4).
Графіки (рис. 2.10) дійсні для газу, що не містить значних кількостей вуглеводневого компонентів. Більшу частину вуглеводневого компонентів зазвичай становить азот. Тому коефіцієнт сверхсжімаемості газу можна розрахувати за правилом адитивності з формули
де - молярна частка азоту; - коефіцієнт сверхсжімаемості азоту (рис. 2.11); - коефіцієнт стисливості вуглеводневої частини газу.
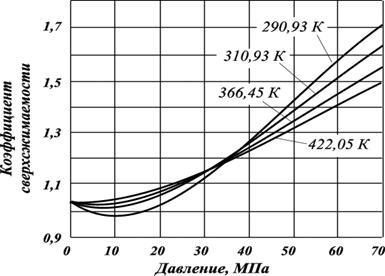
Мал. 2.11. Залежності коефіцієнтів сверхсжімаемості азоту від тиску і температури
За допомогою коефіцієнта сверхсжімаемості z легко визначити обсяги газу V в різних умовах. Відповідно до рівняння (2.30) обсяг газу в будь-яких умовах (температура Т і тиск р) буде дорівнює
Об'ємний коефіцієнт газу використовується при перерахунку обсягу, займаного газом при нормальних умовах на пластові умови, і навпаки, наприклад, при підрахунку запасів.