Микола Миколайович Бекетов (1827-1911)
1. Чим менше значення має електродний потенціал металу, тим він хімічно активніше, легше окислюється і важче відновлюється зі своїх іонів. Активні метали в природі існують тільки у вигляді сполук Na, K. зустрічаються в природі, як у вигляді сполук, так і у вільному стані Cu, Ag, Hg; Au, Pt - тільки у вільному стані;
2. Метали, які мають більш негативний електродний потенціал, ніж магній, витісняють водень із води;
3. Метали, що стоять у ряді напруг до водню, витісняють водень з розчинів розбавлених кислот (аніони яких не виявляють окисних властивостей);
4. Кожен метал ряду, що не розкладає воду, витісняє метали, що мають більш позитивні значення електродних потенціалів з розчинів їх солей;
5. Чим більше відрізняються метали значеннями електродних потенціалів, тим більшого значення е.р.с. матиме побудований з них гальванічний елемент.
Залежність величини електродного потенціалу (Е) від природи металу, активності його іонів в розчині і температури виражається рівнянням Нернста
де Е о Ме - електродний потенціал металу, aMe n + - активність іонів металу в розчині. При стандартній температурі 25 о С, для розбавлених розчинів замінюючи активність (а) концентрацією (с), натуральний логарифм десятковим і підставляючи значення R. T і F, отримаємо
Наприклад, для цинкового електрода, поміщеного в розчин своєї солі, концентрацію гідратованих іонів Zn 2+ × mH2 O скорочено позначимо Zn 2+. тоді
Якщо [Zn 2+] = 1 моль / дм 3. то ЕZn = Е о Zn.
Гальванічні елементи, їх електрорушійна сила
Два металу, занурені в розчини своїх солей, з'єднані провідником, утворюють гальванічний елемент. Перший гальванічний елемент був винайдений Олександром вольт в 1800 р Елемент складався з мідних і цинкових пластинок, розділених сукном, змоченим розчином сірчаної кислоти. При послідовному з'єднанні великої кількості пластинок елемент Вольта володіє значною електрорушійної силою (е.р.с.).
Виникнення електричного струму в гальванічному елементі обумовлено різницею електроднихпотенціалів взятих металів і супроводжується хімічними перетвореннями, що відбуваються на електродах. Розглянемо роботу гальванічного елемента на прикладі мідно-цинкового елемента (Дж. Даніеля - Б.С. Якобі).
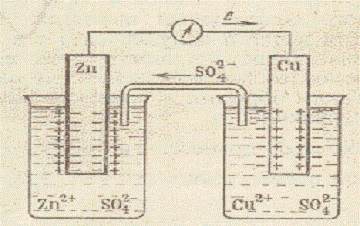
Схема мідно-цинкового гальванічного елемента Даніеля-Якобі
Борис Семенович Якобі (Моріц Герман) (1801-1874)
На цинковому електроді, опущеному в розчин сульфату цинку (з = 1 моль / дм 3), відбувається окислення цинку (розчинення цинку) Zn про - 2e = Zn 2+. Електрони надходять в зовнішній ланцюг. Zn - джерело електронів. Джерело електронів прийнято вважати негативним електродом - анодом. На електроді з міді, зануреному в розчин сульфату міді (з = 1 моль / дм 3) відбувається відновлення іонів металу. Атоми міді осідають на електроді Cu 2+ + 2e = Cu о. Мідний електрод позитивний. Він є катодом. Одночасно частина іонів SO4 2- переходять через сольовий місток в посудину з розчином ZnSO4. Склавши рівняння процесів, що протікають на анод і катод, отримаємо сумарне рівняння
або в молекулярній формі
Це звичайна окислювально - відновна реакція, що протікає на кордоні метал-розчин. Електрична енергія гальванічного елемента виходить за рахунок хімічної реакції. Розглянутий гальванічний елемент можна записати у вигляді короткої електрохімічної схеми
Необхідною умовою роботи гальванічного елемента є різниця потенціалів, вона називається електрорушійної силою гальванічного елемента (е.р.с.). Е.р.с. всякого працюючого гальванічного елемента величина позитивна. Для обчислення е.р.с. гальванічного елемента треба з величини більш позитивного потенціалу відняти величину менше позитивного потенціалу. Так е.р.с. мідно-цинкового гальванічного елемента при стандартних умовах (t = 25 о С, з = 1 моль / дм 3. Р = 1 атм) дорівнює різниці між стандартними електродними потенціалами міді (катода) і цинку (анода), тобто
У парі з цинком іон Cu 2+ відновлюється.
Необхідну для роботи різницю електродних потенціалів можна створити, використовуючи один і той же розчин різної концентрації і однакові електроди. Такий гальванічний елемент називається концентраційним. а працює він за рахунок вирівнювання концентрацій розчину. Прикладом може служити елемент, складений з двох водневих електродів
Якщо р = 101 кПа, з ` <с``, то его э.д.с. при 25 о С определяется уравнением
При з` = 1 моль-іон / дм 3 е.р.с. елемента визначається концентрацією водневих іонів у другому розчині, тобто Е = 0,059lgс`` = -0,059 pH.
Визначення концентрації іонів водню і, отже, рН середовища виміром е.р.с. відповідного гальванічного елемента називається потенціометра.