розчини
Якщо в воду додати цукор, він розчиниться і вийде розчин цукру у воді. Якщо в розчин не буде частинок цукру, такий розчин буде однорідним (однорідним). У цьому розчині цукор виступає як розчинена речовина, вода - розчинник. Якщо в розчин невеликими порціями додавати цукор, він буде розчинятися лише до певної межі, коли додаються в розчин кристали цукру не будуть відразу ж опускатися на дно посудини навіть при ретельному перемішуванні. Розчин, в якому розчинилося все можливе кількість розчинної речовини при певній температурі, називається насиченим. Кількість розчиненого речовини називається розчинністю.
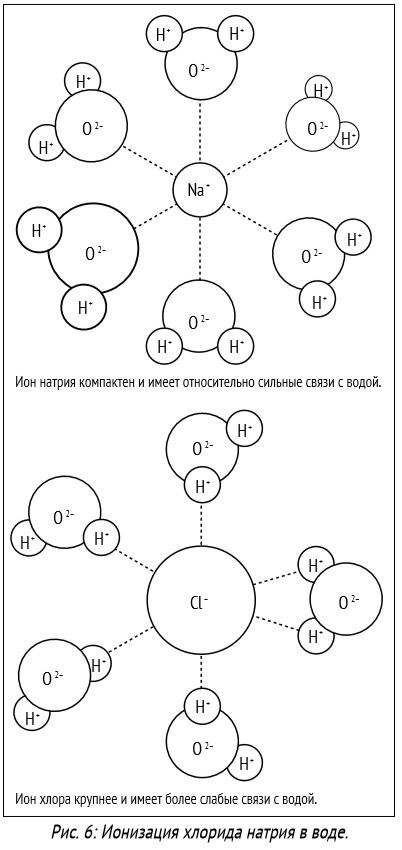
1. Температура. З ростом температури розчинність більшості твердих речовин і рідин підвищується. Розчинність газів при підвищенні температури зазвичай знижується.
2. pH. pH - міра відносної кислотності або лужності розчину (докладний опис буде дано нижче). Розчинність багатьох хімреагентів залежить від рівня pH. Деякі сполуки, наприклад полівалентні солі гідроксиду і карбонату, стають більш розчинними в кислотному середовищі. Деякі сполуки розчиняються тільки в середовищі з нейтральним pH, інші (органічні кислоти, такі як лігніт і лігносульфонат) розчиняються краще при підвищенні pH до> 9,5. Іони кальцію і магнію розчиняються при рівнях pH від кислотного до нейтрального, однак стають менш розчинні при високих рівнях pH (див. Приклад з кальцієм на Рис. 7).
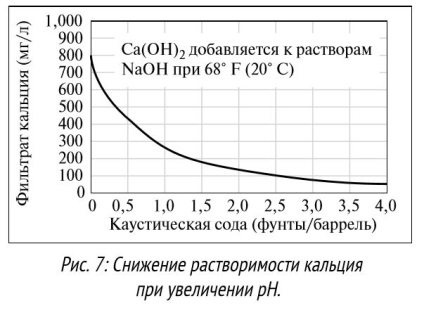
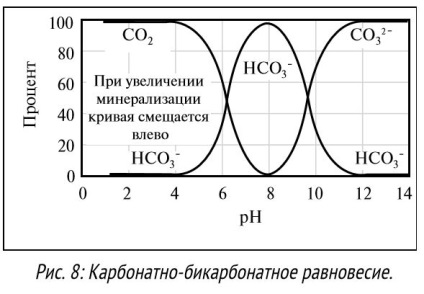
При збільшенні числа гідроксідіонов в міру зростання pH, іони реагують з кальцієм і магнієм, при цьому утворюється осад з гідроксиду кальцію і магнію. Деякі сполуки, наприклад іони карбонату або сульфіду, зі збільшенням рівня pH змінюють свій стан. Наприклад, газ СO2 при реакції з водою утворює вуглекислоту при низькому рівні pH. При нейтральному pH СO2 реагує з гідроксидом, утворюючи іони бікарбонату, при високому pH - іони карбонату (див. Рис. 8). Розчинність багатьох компонентів бурових розчинів безпосередньо залежить від рівня pH розчину. Наприклад, при pH> 9,5 краще розчиняються не тільки лігніт і лігносульфонат, а й добавки, такі як ксантанова смола, стають більш ефективні при рівні pH від 7 до 11. Деякі добавки особливо чутливі до високого рівня pH. При високому рівні pH (> 10,5) добавка полиакриламида гидролизируется, її ефективність знижується. Більшість добавок призначені для застосування в певному діапазоні pH. Для кращого розчинення інгредієнтів, боротьби з корозією свердловинного обладнання та безпечного поводження з хімічними. реагентами pH бурових розчинів на водній основі зазвичай підтримується на рівні від 8 до 12. Інженери з бурових розчинів повинні знати про допустимі рівні pH і підтримувати pH розчину в допустимих межах.
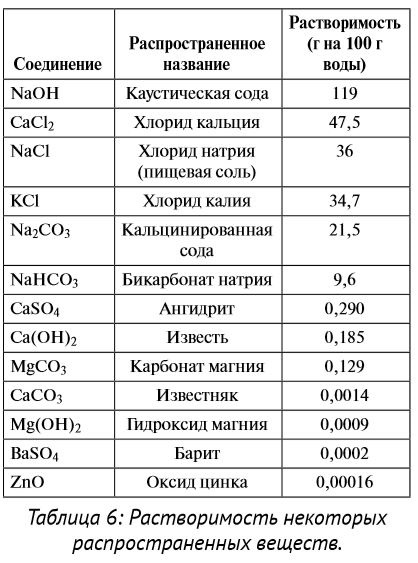
4. Тиск. При збільшенні тиску спостерігається збільшення розчинності газів в рідинах, проте тиск практично не впливає на розчинність рідин і твердих речовин. Підвищена розчинність газів найбільш важлива з точки зору хімічних умов в свердловині, коли пластової газ під тиском розчиняється в буровому розчині. Знати відносну розчинність необхідно тому, що найменш розчинний реагент першим випадає в осад. Наприклад, при змішуванні хлориду кальцію (це речовина з високою розчинністю) з водою хлорид кальцію розпадається на іони кальцію і хлору. Якщо в цей же розчин додати кальциновану соду (речовина з середньою розчинність), вона розпадеться на іони натрію і карбонату, а карбонат кальцію (речовина з низькою розчинністю) негайно випаде з розчину при реакції добре розчинної кальцію і добре розчинної карбонату. Відносна розчинність може бути використана при виборі реагентів для видалення непотрібних з'єднань з розчину. На розчинність впливають іони різних елементів і сполук, що містяться в розчиннику.