- 6.1. Теплові ефекти хімічних реакцій
Ключові Терміни:
6.1. Теплові ефекти хімічних реакцій
Термохімією називається розділ хімічної термодинаміки, в якому розглядається застосування першого закону для обчислення теплових ефектів різних фізико-хімічних процесів: хімічних реакцій, фазових переходів, процесів кристалізації, розчинення і ін. Для практики найбільший інтерес мають термохимические розрахунки теплових ефектів хімічних реакцій.
Тепловим ефектом хімічної реакції називається кількість теплоти, що виділяється (екзотермічні реакцій) або поглинається (ендотермічні реакції) при незворотному протіканні реакції, коли єдиною роботою є тільки робота розширення.
Отже, для хімічних реакцій справедливо співвідношення першого закону термодинаміки
- [TEX] \ delta = dU + PdV [/ TEX], (6.1)
- тут [TEX] Q [/ TEX] - тепловий ефект хімічної реакції,
- [TEX] \ delta = PdV [/ TEX] - робота, що здійснюються системою в ході реакції.
Тепловий ефект хімічної реакції, що протікає при постійному обсязі, називається изохорический тепловим ефектом і позначається [TEX] Q_ [/ TEX]. Так як в цьому випадку [TEX] PdV = 0 [/ TEX], то
Отже, тепловий ефект хімічної реакції, що протікає при постійному об'ємі, дорівнює зміні внутрішньої енергії системи.
Изобарических тепловий ефект реакції [TEX] \ left (Q_\ Right) [/ TEX] можна знайти, інтегруючи рівняння (6.1):
Изобарических тепловий ефект хімічної реакції дорівнює зміні ентальпії системи.
Таким чином, изохорический і изобарических теплові ефекти рівні змін функцій стану. Отже, вони не залежать від шляху процесу, а визначаються тільки початковим і кінцевим станами системи. Незалежність теплових ефектів реакцій від їх шляху була встановлена російським ученим академіком Г.І. Гессом в 1840 році на підставі експериментальних даних.
закон Гесса
Закон Гесса встановлює, що якщо з даних вихідних речовин можна різними шляхами отримати задані кінцеві продукти, то незалежно від шляху отримання, тобто від числа і виду проміжних реакцій, сумарний тепловий ефект для всіх шляхів буде одним і тим же.
Іншими словами, парниковий ефект хімічної реакції залежить тільки від виду та стану вихідних речовин і продуктів реакції і не залежить від шляху переходу.
З'ясуємо зміст закону Гесса на прикладах. Так як найчастіше хімічні реакції протікають при постійному тиску, будемо їх тепловий ефект характеризувати зміною ентальпії [TEX] \ Delta [/ TEX]. Уявімо собі процес перетворення вихідних речовин [TEX] A _ [/ TEX], [TEX] A _ [/ TEX], [TEX] A _ [/ TEX]. в продукти, [TEX] B _ [/ TEX], [TEX] B _ [/ TEX], [TEX] B _ [/ TEX]. причому перетворення це може бути скоєно різними шляхами:- Прямою реакцією перетворення речовин А в речовини В з тепловим ефектом [TEX] \ Delta> [/ TEX].
- Реакцією, що складається з двох стадій з тепловими ефектами [TEX] \ Delta> [/ TEX] і [TEX] \ Delta> [/ TEX].
- Сукупністю реакцій з тепловими ефектами [TEX] \ Delta> [/ TEX], [TEX] \ Delta> [/ TEX], [TEX] \ Delta> [/ TEX], [TEX] \ Delta> [/ TEX].
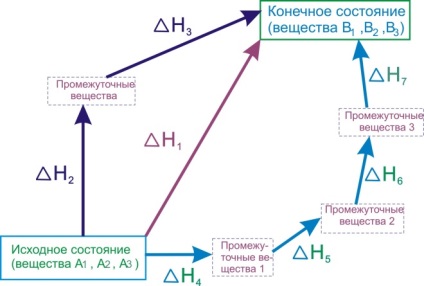
Малюнок 6.1 - Ілюстрація закону Гесса
Закон Гесса стверджує, що ці теплові ефекти пов'язані між собою співвідношенням:
Практичне значення закону Гесса полягає в тому, що він дозволяє обчислити теплові ефекти таких реакцій, для яких вони безпосередньо не можуть бути виміряні. Наприклад, тепловий ефект [TEX] \ Delta H_ [/ TEX] реакції [TEX] C + 1/2 O_ = CO [/ TEX] не можна визначити безпосереднім виміром, так як одночасно з цією реакцією завжди має місце реакція освіти [TEX] CO_ [/ TEX]. Для визначення [TEX] \ Delta> [/ TEX] використовуємо теплові ефекти наступних реакцій:Відповідно до закону Гесса
Теплові ефекти хімічних реакцій можуть бути виміряні та експериментально в спеціальних приладах, званих калориметрами. Точні калориметричні вимірювання досить трудомісткі і вимагають багато часу. Тому їх проводять тільки в разі неможливості використання закону Гесса.
При написанні термохімічних рівнянь реакцій вказують агрегатний стан реагентів і тепловий ефект реакції:
Такий запис означає, що при реакції 1 моль газоподібного ацетону [TEX] C_H_O [/ TEX] з 4 моль газоподібного кисню виходить 3 моль газоподібного [TEX] CO _ [/ TEX] і 3 моль рідкої води. При цьому виділяється 1817,0 кДж теплоти на 1 моль ацетону.
Так як теплові ефекти залежать від фізичного стану реагуючих речовин і умов, при яких протікає реакція, то для проведення термохімічних розрахунків, теплові ефекти, що вводяться в термохимические рівняння, повинні бути віднесені до якихось однакових умов, в іншому випадку вони непорівнянні. За такі умови приймають умови, при яких реакція здійснюється між речовинами, що знаходяться в стандартних станах.
За стандартний стан індивідуальних рідких і твердих речовин приймають їх стійкий стан при температурі 298,15 К ([TEX] 25<^>C; [/ TEX]) і тисків 101325 Па, а для газів - таке їх стан, коли при тиску 101325 Па і температурі 298,15 К вони підкоряються рівняння стану ідеального газу. Тому, теплові ефекти реакцій при стандартних умовах позначають [TEX] \ Delta_ ^ 0 [/ TEX] і [TEX] \ Delta_ ^ 0 [/ TEX].Із закону Гесса випливають слідства, що мають велике практичне значення.