Як видно з наведених рівнянь, при тепловому розрахунку реактора необхідно обов'язково знати ентальпії реакцій, ентальпії фазових переходів компонентів і теплоємності компонентів.
Якщо відсутня табличне значення, то ентальпію реакції можна ви-
ділити за стандартними ентальпії освіти або згоряння компонентів в з
відно до закону Гесса. для реакції
АА + ВВ = rR + sS + # 8710; Нr,
стандартна ентальпія реакції, розрахована за ентальпії освіти, дорівнює
Відповідно по ентальпії згоряння
Значення стандартних ентальпій утворення та згоряння можна знайти в довідниках фізико-хімічних величин. Значення ентальпії реакції при температурі реакції визначається рівнянням
де СРI - молярна теплоємність i-того компонента; Т0 - «стандартна» температура; Т - розрахункова температура.
Ентальпії компонентів можна розрахувати, використовуючи ентальпії фазових пере
ходів і температурні залежності теплоємності фаз. При умові завдання рівня відліку Тс загальна формула при цьому буде мати вигляд
Індекс «пл» відноситься до температури і ентальпії плавлення, «кип» - до температури і ентальпії кипіння; «Т», «ж» і «г» - відповідно до твердого тіла, рідини і газу. Температурні залежності теплоємності для багатьох речовин можна знайти в довідниках фізико-хімічних величин, де вони виражаються формулами:
Якщо в даному температурному інтервалі в зазначених рівняннях не опиниться коефіцієнтів, то можна взяти середнє значення теплоємності, отримане з таблиць, або ж розраховане по емпіричних залежностях.
Емпіричні залежності розрахунку теплоємності залежать від фазового стану речовини. Так мольну теплоємність металів і інших кристалічних речовин можна орієнтовно розрахувати за правилом Дюлонга і Пті, яке передбачає, що кожен атом з'єднання вносить в молекулу частку теплоємності, рівну приблизно 26 Дж / (моль # 8729; К). Тому розрахунок питомої теплоємності з'єднання можна провести за формулою
де n - число атомів в молекулі; М - молекулярна маса сполуки, кг / моль.
Теплоємність багатьох твердих речовин - величина адитивна і приблизно дорівнює сумі атомних теплоємність (правило Коппа):
,
де ni - число атомів даного виду; Сi - атомна теплоємність, що обирається, з табл. 9.7.
Таблиця 9.7. Атомні складові теплоємності твердих речовин
Тут СV і СP - теплоємності при постійному обсязі і постійному тиску, відповідно, а R - універсальна газова постійна; R = 8,314 Дж / (моль # 8729; К).
Орієнтовне значення питомої теплоємності в Дж / (кг # 8729; К) можна отримати з наступних формул:
де n - число атомів в молекулі газу або пари; М - його молекулярна маса, кг / моль.
Залежність теплоємності газів і парогазових сумішей від тиску і температури орієнтовно визначається за формулою
де СР - теплоємність при атмосферному тиску, Дж / (моль # 8729; К);
π - наведене надлишковий тиск газу, π = Р / РКР; Р - надлишковий тиск газу, Па; РКР - критичний тиск газу, Па; # 964; - наведена температура газу,
# 964; = Т / Ткр; Т - температура газу, К; Ткр - критична температура газу.
Теплоємність газових і парогазових сумішей можна наближено визначити з виразу
де хі - молярна або об'ємна частка компонента в суміші.
Приклад 9.7. Визначити теплоємність азоту при температурі 50 ° С і абсолютного
ном тиску 20 МПа.
Рішення: За літературними даними для азоту критична температура дорівнює 125,9 К, критичний тиск - 3,285 МПа, молекулярна маса - 0,028 кг / моль. Визначимо ізобарну теплоємність при звичайній температурі і атмосферному тиску
СР = 1 = 3,5 # 8729; 8,314 = 29,1 Дж / (моль К).
# 964; = Т / Ткр = (273 + 50) / 125,9 = 2,566
Наведене надлишковий тиск
СР = 29,1 + (2,531 # 8729; 8,314 # 8729; 5,783) / 2,566 = 36,6
Або по питомої теплоємності
Питома теплоємність переважної більшості рідин лежить в межах 1600 - 2400 Дж / (моль # 8729; К), для більшості вуглеводнів цей параметр приблизно дорівнює 2100 Дж / (моль # 8729; К).
Орієнтовну оцінку мольной теплоємності рідин можна провести, використовуючи правило Коппа, яке може бути застосовано для температури 20 ° С:
де ni - число атомів даного виду; Сi - атомна теплоємність, що обирається, з табл. 9.9.
Мольную теплоємність рідин при 20 ° С можна обчислити за методом Джонсона - Хуанга:,
де аi - атомна чи групова складові (див. табл. 9.10).
Таблиця 9.9. Атомні складові теплоємності рідин
Приклад 9.8 Обчислити за методом Джонсона - Хуанга теплоємність бензолу (С6 Н6) при 20 ° С.
Рішення: Бензол можна уявити що складається з шести груп = СН-, тоді Ср = 6 # 8729; 22,6 = 135,6 Дж / (моль # 8729; К).
Дослідне табличне значення 136,2 Дж / (моль # 8729; К).
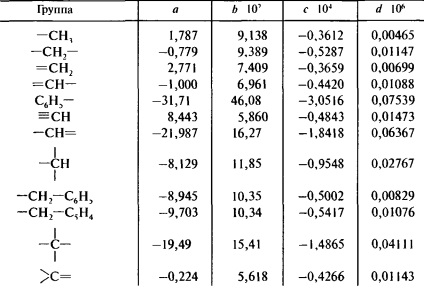
Друга формула Джонсона - Хуанга дає можливість отримати температурну залежність теплоємності
СР = а + Bт + сТ 2 + dТ 3
Коефіцієнти а, b, с і d представлені в табл. 9.11.
Важливою характеристикою при тепловому розрахунку реакторів може бути ентальпія випаровування. У тому випадку, якщо не можна знайти її табличне значення, її можна розрахувати. Найбільш простим, але і не цілком точним методом є правило трутони:
де Lісп.к - ентальпія випаровування при температурі кипіння, Дж / моль; Тк - температура кипіння, К.
Більш точним є метод Джіаколоне:
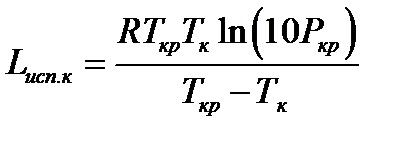
де Ткр і РКР - критичні температура (К) і тиск (МПа).
Таблиця 9.11. Розрахунок теплоємності за методом Джонсона-Хуанга
Ентальпію плавлення можна приблизно визначити за формулою
де Lпл - ентальпія плавлення, Дж / моль; Тпл - температура плавлення, К.
Для органічних сполук співвідношення між ентальпії випаровування і плавлення має вигляд