Іон марганцю Мn2 + не володіє забарвленням у водному розчині. Видалення двох електронів з 4s-орбіталі НЕ силь-но зачіпає стану внутрішніх d-електронів, кото-яких у марганцю якраз п'ять і кожен займає одне з п'яти можливих станів. Однак більш високі ступені окислення вже сильно впливають на ці електрони.
Кристали МnSO4 або МnСОз безбарвні (іноді МnСОз світло-рожевий), але оксид МnО сіро-зелений, МnСl2 і Mn (NO3) 2 рожеві. Якщо в морській воді створюється підвищена-шенная концентрація марганцю, то це позначається на освіті коралів, перламутру і перлів. В Японії існують спеціальні підводні плантації, де раз-водять жемчужниц - двостулкових молюсків. У цих організмів на внутрішній поверхні раковин отклад-ються пластинчасті шари арагонита - одна з кристалічних форм карбонату кальцію (про другий - кальциті - згадувалося в зв'язку зі сталактитами). Якщо в ці шари потрапляють іони марганцю, то шари починають набувати рожевий відтінок і виходить рожевий перли. Включення в них інших іонів надає жовтуватий відтінок, а дуже рідко перли буває навіть чорним. Так як перли по состааву - це карбонат кальцію, то він може виникнути і в підземних печерах. У печерах в Новому Афоні був обна-Ружені такий перли в досить значній кількості.
Ступені окислення марганцю +3 відповідає бурий колір Мn2Оз або чорно-коричневий у Мn3O4. Правда, по-останньої з'єднання містить не тільки Мn3 +, але і Мn4 +, який і поглиблює колір. У звичайних умовах МnO2 - чорні кристали. Іон Мn6 + може бути присутнім тільки в складі аніона MnO42-, пофарбованого в зелений колір. Кіс-лота Н2МnO4, що відповідає цьому аниону, у вільному вигляді не виділена, а що утворюється з солей при підкисленні розчинів манганатов:
К2МnО4 + 2СН3СООН → Н2МnО4 + 2СН3СООК
мимовільно розпадається на темно-коричневий МnО2 і перманганат КМnO4:
ЗК2МnО4 + 4СН3СООН → МnО2 + 2КМпО4 +
Аниону МnО4-, де ступінь окислення марганцю найвища + 7, відповідає вже інший - фіолетово-малиновий колір. Кожен його напевно бачив - це колір рас-твора «марганцівки».
Така різноманітність кольорів з'єднань марганцю раз-особистих ступенів окислення і їх одночасне поєднання в розчині дозволило К. Шеєле назвати К2МnO4 мінеральним хамелеоном. У 1774 році цей дослідник отримав манганат калію сплавом:
МnO2 + 2КОН + KNO3, → K2MnO4 + KNO2 + Н2О
Продукт реакції дав з водою розчин зеленого кольору, але поступово при стоянні на повітрі (під дією кисло-роду) став перетворюватися спочатку в синій, потім в Фіоль-товий і під кінець став малиновим (забарвлення МnО4-).
Така різноманітність кольорів пояснюється зміною характеру іонів марганцю. Чим вище ступінь окислення, тим більше поляризующее дію марганцю. Справа доходить до того, що Мn + 6 і Мn + 7 є одними з сильних окислювачів. У води вони відбирають іон кисню, созда-вая собі оточення з чотирьох іонів O-2. Різниця в стані лише одного електрона визначає колір - зелено-ний або фіолетово-малиновий, але крім цього - окисли-тільні здатності.
Щось схоже відбувається і з іонами хрому. Гідратований іон хрому Сr2 + блакитного кольору. Це один з са-мих сильних відновників. Він нестійкий ні в розчині-ре, ні в складі твердої речовини. Одне з його щодо відповідності-но стійких (за відсутності повітря) з'єднань - ацетат Сr (СНзОО) 2. Поляризующее дію іона Сr2 + таке, що ацетат набуває червоного кольору. Іон Сr2 + прагне пе-Рейт в Сr3 +, який має в розчині вже інший колір - зелений, а деякі з його сполук - фіолетовий (наприклад, СrС1з). Окисленням пероксидом натрію можна перевести хром в його вищу ступінь окислення +6:
2NaCrO2 + 3Na2O2 + 2H2O → 2Na2CrO4 + 4NaOH
Такий іон Сr6 + може входити до складу аніону двох киць-лот: хромової - Н2СrО4 і двухромову - Н2Cr2O7. Каждо-му з них властива своя забарвлення: першого - жовта, а другого - помаранчева. Перекласти з однієї форми в дру-гую можна додаванням кислоти або лугу:
2CrO4- + 2Н + → Н2О + Сг2О72-
Cr2O72- + 2OH- → 2CrO42- + H2O
Природно, що хром, що знаходиться в надзвичайно окислення, - сильний окислювач:
К2Cr2O7 + ЗC2H5ОН + 4H2SO4 → CH3CHO + Cr2 (SO4) 3 +
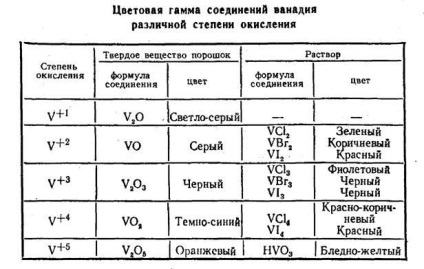
Ступінь окислювання визначається станом валентних електронів. Кожній ступеня окислення відповідає свій колір і свій характер. Від блакитного нестійкого іона +2 з відновними властивостями до Сr6 + - окислювача проходить ціла гама кольорів. Зміна властивостей іона і зміна кольору мають одну і ту ж основу - визначено-ве стан електронів. Перехід від одного ступеня окис-лення до іншого робить електронну систему іона чув-ствительность до світлових квантів суворо визначеній енер-гии, відповідної різниці енергетичних d-підрівнів. Різноманіття кольору іонних станів одного і того ж елемента доводить, що ця різниця досить тонка. Подібні кольорові гами існують і в інших перехідних елементів. Як приклад наведемо изме-нение кольору твердих сполук - оксидів і розчинів галогенідів ванадію (табл. 2).
Зміна кольору розчинів відповідно до ступеня окислення властиво і неметаллам. Так, йод в свобод-ном стані має фіолетовий колір. У 100-відсоткової сірчаної кислоти розчин йоду має рожевий колір, він відпо-ветствует комплексному йону I3 +. Цей комплекс складається з молекули йоду і адсорбованого на ній катіона I +, При додаванні окислювача:
2I3 + + НIO3 + 8H2SO4 = 7I + + ЗН3O + + 8HSO4-
колір розчину, де присутній в основному іон I +, стано-вится темно-синім.
Середовище впливає на колір
Катіони, аніони в розчині оточені оболонкою раст-ворітеля. Шар таких молекул, безпосередньо примикаючи-чих до іона, називають сольватной оболонкою (від слова solver - розчиняти). Число вхідних сюди молекул визна-ділити важко. Нас, втім, цікавить інший ефект сольватації.
У розчинах іони можуть впливати не тільки один на одного, але і на навколишні їх молекули розчинника, а ті в свою чергу на іони. При розчиненні і в резуль-таті сольватации виникає колір у іона раніше безбарвного. Наприклад, безводні CuF2 і CuSO4 білі, а їх розчини забарвлені в блакитний колір. Це забарвлення гідратованого іона міді. У його найближче оточення входить як міні-мум шість молекул води. Чотири з них пов'язані з ним міцно, а дві - слабо. Заміна оточення іона з погано деформуються іонів F- і SО42- на легко поляризованість молекули води призводить до появи кольору. Видалення води (наприклад, виправними) призводить до випадання кристаллогидратов того ж кольору. Адже в них містяться молекули води. Так, в кристалогідраті сульфату міді CuSО4 • 5H2О чотири з п'яти молекул розміщені навколо іона міді, а п'ята займає проміжне положення і пов'язана як з Сu2 +, так і з групою SO42- (рис. 11).
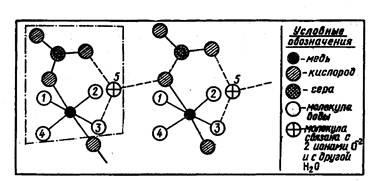
Мал. 11. Схема будови кристаллогидрата модного купоросу. У рам-ку укладена одна молекула CuSО4 • 5H2О. Штрих означає, що молекула Н2О пов'язана з двома іонами кисню та іншої молекулами-лій води.