H2 SO4 - ббесцветная масляниста рідина, щільність 98% розчину 1,84 г / см, - нелетка і запаху не має. Надзвичайно гігроскопічна, легко поглинає воду. При розчиненні виділяється велика кількість тепла.
Хімічні властивості: 1. Сильна кислота, розпадається на іони за двома ступенями практично на 100%, утворює два ряди солей.
HSO4 - ↔ H + + SO4 2- - сульфат іон
Розбавлена кислота H2 SO4 володіє всіма загальними властивостями кислот: змінює забарвлення розчинів індикаторів); взаємодіє з підставами, основними оксидами і солями (реакції іонного обміну, які не ОВР!):
У всіх цих реакціях головну роль відіграють іони водню, а SO4 2- просто присутній в розчині. Специфічною реакцією іона SO4 2- (тобто сірчаної кислоти і всіх її солей) є реакція з солями барію.
2H + + SO4 2+ Ba 2+ + 2Cl - → 2H + + 2Cl - + BaSO4 ↓
Цю реакцію називають «якісною реакцією» на сірчану кислоту і її солі, тому що в ній утворюється характерний мелкокристаллический білий осад BaSO4. Реакцію використовують в лабораторній практиці для визначення наявності в розчині іона SO4 2-.
При взаємодії з металами сірчана кислота може вести себе по-різному, в залежності від концентрації і активності металу.
У розведеної H2 SO4 окислювачем є іон Н +. тому розбавлена сірчана кислота взаємодіє тільки з металами стоять в ряду напруг до водню, причому, одним з продуктів реакції буде газ водень.
Zn 0 - 2 e - → Zn +2 H + + e - → H 0
Але якщо ми візьмемо концентровану кислоту, то в ролі окислювача виступить S +6. і замість водню ми отримаємо продукт її відновлення - якесь з'єднання сірки. Яке? Це залежить від активності металу, температури, концентрації кислоти. Зазвичай утворюється суміш таких речовин. Але, спрощуючи, можна вважати, що чим активніше метал, тим більш глибоко йде процес відновлення, і ступінь окислення сірки в продукті реакції буде нижче. Слід також зазначити, що з концентрованою H2 SO4 взаємодіють всі метали, крім золота і платини, але на холоду залізо, алюміній і хром пасивуються (не реагують через утворення міцної плівки на поверхні металу), а деякі метали не реагують і з розбавленою сірчаною кислотою (якщо при цьому утворюється нерозчинна сіль).
H2 SO4 (конц.) + Ca → CaSO4 + H2 Про + CaS Ca 0 - 2 e - → Ca 2+ S +6 + 8e - → S -2
H2 SO4 (конц.) - сильний окислювач, і може окисляти не тільки метали, а й неметали і навіть їх сполуки, обугливает органічні речовини (тому що забирає воду, наприклад, у вуглеводів)
C 0 - 4e - → C 4+ S +6 + 2e - → S +4

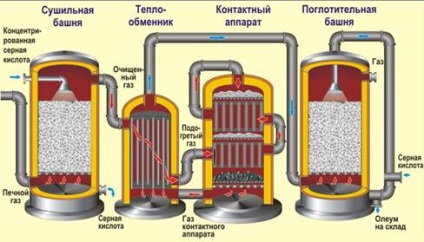
1) випал колчедану (принцип теплообміну, в «киплячому шарі», повітря збагачений киснем):
2) каталітичне окислення сірчистого газу (450 0 С, каталізатор V2 O5 оксид ванадію (V), принцип протитоку):
Кінцевим продуктом є «олеум» - розчин SO3 в концентрованій H2 SO4.
У виробництві сірчаної кислоти часто використовують сірчистий газ, одержуваний при випаленні кольорових руд, горінні палива або вільної сірки. Тобто перша стадія може бути трохи інший, а ось дві останні - завжди однакові.
Застосування. Сірчана кислота - «хліб» хімічної промисловості.
- K2 SO4 і (NH4) 2 SO4 - сульфати калію і амонію, в с / г як мінеральні добрива
- CuSO4 # 8729; 5H2 O - мідний купорос, в с / г як засіб боротьби з хворобами рослин, в легкій промисловості як барвник, в будівництві як протигрибковий засіб, в гальванопластике (покриття шаром міді)
FeSO4 # 8729; 7H2 O - залізний купорос, в с / г засіб боротьби з шкідниками рослин, у легкій промисловості при фарбуванні тканин.
CaSO4 # 8729; 2H2 O - мінерал гіпс, в будівництві використовують «палений гіпс» 2CaSO4 # 8729; H2 O під назвою «алебастр» до складу шпаклівок, в медицині - зліпки, шини, в художньо-прикладній творчості.
Na2 SO4 # 8729; 10H2 O - глауберової сіль, в медицині як проносне, у виробництві скла
BaSO4 -в медицині, (рентген шлунка), у виробництві паперу, гуми як наповнювач
2) в кольоровій металургії (гідрометалургія, отримання міді, нікелю і т.д.) і обробці металів (друковані плати, гальваніка, акумулятори тощо)
3) неорганічний синтез (виробництво мінеральних добрив, пігментів, кислот ...) і органічний синтез (виробництво барвників, ВВ, полімерів ...)
4) виробництво паперу
5) виробництво соди (скло, СМС)
Солі сірчаної кислоти не мають окислювальні властивості, вступають у звичайні реакції іонного обміну.