Ступінь електролітичноїдисоціації Оскільки електролітична дисоціація - процес оборотний, то в розчинах електролітів поряд з їх іонами присутні і молекули. Іншими словами, різні електроліти, відповідно до теорії С. Арреніуса, диссоциируют на іони в різного ступеня. Повнота розпаду (сила електроліту) характеризується кількісної величиною - ступенем дисоціації. Ступінь дисоціації (# 945; -Грецька буква альфа) - це відношення числа молекул, що розпалися на іони (n), до загального числа розчинених молекул (N):
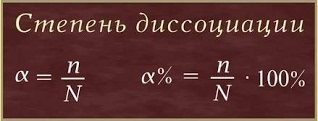
Значення ступеня дисоціації (# 945;)
1. Розчинні солі; 2. Сильні кислоти (НСl, HBr, HI, НNО3. НClO4. Н2 SO4 (разб.)); 3. Сильні підстави - лугу.
1. Майже всі органічні кислоти (CH3 COOH, C2 H5 COOH і ін.); 2. Деякі неорганічні кислоти (H2 CO3. H2 S і ін.); 3. Майже всі малорозчинні у воді солі, підстави і гідроксид амонію (Ca3 (PO4) 2; Cu (OH) 2; Al (OH) 3; NH4 OH); 4. Вода.
1) Одного разу в хімічному форумі один школяр написав: «а я ваще не розумію (саме так було написано) чому NaCl в розчині розпадається на Na + і Cl -. а не на Na - і Cl + ». Як би ви пояснили бідоласі суть того, що відбувається в розчині? Який важливий розділ хімії свого часу «прогуляв» наш невдалий школяр?
Приклади РІШЕННЯ ЗАВДАНЬ:
Завдання 1. Визначте, чому дорівнює ступінь дисоціації електроліту, якщо при 20 ° С з кожних 150 молекул розпалося на іони 90. Сильний або слабкий це електроліт?
Завдання 2. Визначте, скільки молекул електроліту продіссоцііровало в розчині, якщо ступінь дисоціації електроліту дорівнює 0,1, а в розчин було введено 3,01 • 10 20 молекул.
Завдання для самоконтролю
1. Розрахуйте ступінь дисоціації борної кислоти Н3 ВО3. якщо відомо, що в розчині з кожних 500 молекул розпалися на іони тільки 40. Сильний, середній або слабкий за силою цей електроліт?
2. Розрахуйте, скільки молекул електроліту продіссоціірует з кожних 120 молекул в розчині, якщо ступінь дисоціації становить 95%.