Хімічна реакція відбувається тоді, коли розриваються одні зв'язку і утворюються інші. Хід тієї чи іншої реакції визначається декількома факторами, головними з яких є природа реагуючих молекул (реактантов) і атакуючих реагентів, температура, концентрація компонентів, каталізатор. Важливе значення для визначення механізму реакції належить природі частинок (проміжних), які утворюються на проміжних стадіях розщеплення хімічного зв'язку.
Дисоціація ковалентного зв'язку $ C-X $ може відбуватися за трьома основними схемами (рис. 1).
В результаті гетеролітичних розриву зв'язку відбувається повне зміщення пари електронів до того чи іншого атома з утворенням відповідних іонів вуглецю - карбаніони або карбокатіони. При гемолитическом розриві зв'язку утворюються вільні радикали.
Природа, освіту і стабільність проміжних частинок
Органічні іони і радикали є основними интермедиатами більшості реакцій і виявляють значну реакційну здатність і виступають в ролі реагентів.
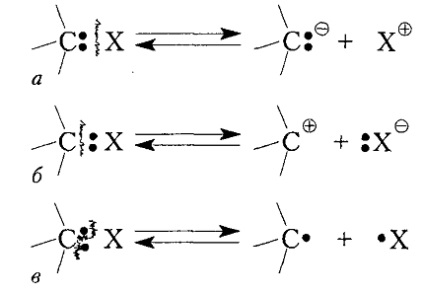
Малюнок 1. Дисоціація зв'язку $ C-X $ з утворенням: а - карбаніони, б - карбокатіон і в - радикала; а і б - гетеролітичні (іонну), в - гемолітична (радикальне) розщеплення
карбокатіони
Карбокатіони мають позитивний повний заряд ($ + I $) на атомі вуглецю, який знаходиться в гібридизувати стані. Тому структура карбокатіон плоска і три гібридні орбіталі розташовані в одній площині під кутами $ 120 ^ \ circ $. Вакантна $ p-AO $ розташована перпендикулярно до цієї площини.
Освіта карбокатіонів. Існує кілька методів освіти карбокатіонів. Основні з них:
- Приєднання протона до певних сполук, серед яких в першу чергу слід назвати ненасичені вуглеводні і спирти.
- Безпосередня іонізація полярної зв'язку $ C-X $ під дією зовнішнього середовища. Такий дисоціації зв'язку крім власної полярності сприяє наявність полярного розчинника або каталізатора, наприклад кислот Льюїса
- При каталітичної ізомеризації алканів і при впливі на алкани суперкислоти начебто комплексу фторсульфоновая кислота - пентафтороантімонат.
стабільність карбокатіонів
Відомо, що енергія гетеролітичні розщеплення зв'язку $ C-X $ з утворенням карбокатіон (рис. 1, б) досить висока і в газовій фазі становить, наприклад, для алканів, 900-1300 кДж / моль. В результаті карбокатіони малостійкі, мають значну реакційну здатність. Стабільність карбокатіон тим вище, чим більше делокалізованних позитивний заряд. Алкільні заступники стабілізують карбокатіон своїми донорними властивостями, сприяють зменшенню електронного дефіциту на атомі вуглецю з позитивним зарядом. Заступники з негативним $ I ^ - $ ефектом дестабілізують карбокатіон, і він стає менш стійким.
Вирішуємо контрольні з усіх предметів. 10 років досвід! Ціна від 100 руб. термін від 1 дня!
Однак індукційні і гіперконьюгаціонние ефекти заступників проявляють відносно слабкі стабілізуючі чинники карбокатіонів, до того ж цей ефект в значній мірі вщухає при видаленні заступника від вільної $ p-AO $. Найбільший вплив на стабільність карбокатіонів виробляє мезомерний ефект ненасичених зв'язків завдяки сполученню вільної $ p-AO $ з $ \ pi $ -зв'язків, розташованого в $ \ alpha $ -положенні до цієї орбіталі
Стабілізація карбокатіонів може здійснюватися також шляхом сполучення вакантної $ p-AO $ карбокатіон центру з нерозділеного парою електронів гетероатома ($ p-p $ -сопряженія):
Малюнок 2. Стабільність алкільних радикалів
Значною мірою на стабільність карбокатіонів впливає розчинник. У полярних середовищах катіон може існувати у вільному стані в результаті його сольватаціонного взаємодії з молекулами розчинника. У неполярних середовищах він може існувати у вигляді іонної пари з протиіоном. В окремих випадках карбокатіони можуть бути настільки стабільними, що існують у вигляді звичайних солей. Наприклад, трифенілметил катіон при нормальних умовах являє собою сіль.
Вирішуємо контрольні з усіх предметів. 10 років досвід! Ціна від 100 руб. термін від 1 дня!
карбаніони
При розміщенні нерозділеного пари електронів на атомі вуглецю виникають інтермедіати, які називаються карбаніони. Вони мають плоске або пірамідальне будова, і нерозділене пара електронів знаходиться на атомній або на гібридизувати орбіталі. Так, для насичених з'єднань характерна пірамідальна або тетраедричних конфігурація, подібна конфігурації з'єднань тривалентного азоту. Нерозділене пара електронів в метил-аніоні займає sp3-гібридну орбіталь. Вважають, що для пірамідальної конфігурації карбаніони характерна швидка інверсія тетраедра подібно до ефекту "вивернутого парасольки" в з'єднаннях $ NR_3 $.
Плоске будова характерно при розташуванні в $ \ alpha $ -положенні до аніонного центру $ \ pi $-зв'язку, наприклад для аліл- аниона.
При розташуванні анионного центру безпосередньо у атома вуглецю з ненасиченої зв'язком нерозділена електронна пара розміщується на відповідній гібридизувати орбіталі ($ sp2- $ або $ sp- $) і не змінює її стану гібридизації, наприклад в разі вініл аниона і етініл-аніону.
отримання карбаніони
Один з відомих методів освіти карбаніони це взаємодія металів з алкилгалогенидами, наприклад:
Малюнок 3. Стабільність алкільних радикалів
Вирішуємо контрольні з усіх предметів. 10 років досвід! Ціна від 100 руб. термін від 1 дня!
Напишемо недорого і точно в строк! Більш 50 000 перевірених фахівців
Зв'язок $ C-Li $ високополярних (ступінь ионности досягає приблизно $ 43 \% $), і з'єднання вважається існуючої у вигляді іонної пари метил-аніону і катіона літію ($ CH_3 \ cdot Li + $). Не слід забувати, що такий запис деякої міри умовно, оскільки $ 57 \% $ зв'язку $ C-Li $ належить ковалентного складової.
Іншим методом карбаніони отримують при взаємодії сполук з сільнополярними зв'язками ($ C-H $-кислоти) і реагентів з основними властивостями:
Малюнок 4. Стабільність алкільних радикалів
стабільність карбаніони
Стабільність карбаніони залежить від делокализации негативного заряду, і може змінюватися при розміщенні в $ \ alpha $ -положенні до аніоном центру електроноакцепторні заступників з негативним ефектом або заступників з $ \ pi $ -зв'язків, які проявляють негативний М-ефект. Прояв мезомерного ефекту полягає в сполученні молекулярної орбіталі $ \ pi $-зв'язку з незв'язний орбиталью нерозділеного пари електронів атома вуглецю ($ p- \ pi $ -сопряженія). Стабілізацію ацетоніл-аніону можна уявити і за допомогою резонансних структур:
Вирішуємо контрольні з усіх предметів. 10 років досвід! Ціна від 100 руб. термін від 1 дня!
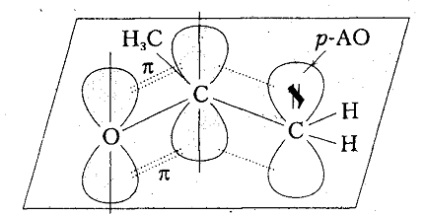
Малюнок 5. Стабільність алкільних радикалів
При розміщенні в ненасиченому фрагменті гетероатома (кисню) з більшою електронегативність, ніж у вуглецю, значна частина від'ємного заряду акумулюється на гетероатомом.
Ще більше зростає стабільність карбаніони під впливом ароматичної системи, наприклад для ціклопентадіенільного аниона:
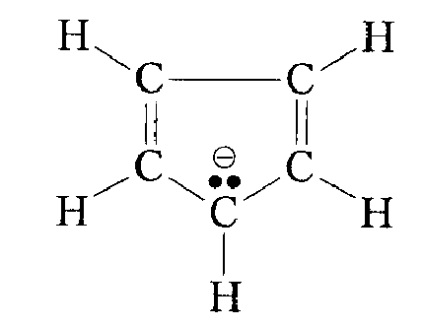
Малюнок 6. Стабільність алкільних радикалів
Крім того, стабільність карбаніони залежить від природи гібридизації атома вуглецю. Чим більше внесок $ x-AO $ в гібридне стан, тим стійкіше карбаніони, тобто відбувається підвищення їх стабільності в ряду $ sp3
Вплив структурних факторів на стабільність аніонів має зворотній напрямок в порівнянні з катіонами. Зокрема, стабільність карбаніони зменшується таким чином: первинний> вторинний> третинний.