При розгляді селективності галогенування алканів в попередньому розділі було встановлено, що для всіх галогенів швидкість заміщення водню у вуглецевого атома знижується в ряду третинний> вторинний> первинний, який прямо протилежний ряду енергій C - H-зв'язків в алканах.
При порівнянні енергій первинної і вторинної зв'язків C - H в пропане видно, що вони відрізняються на 3 ккал / моль. Оскільки вихідна сполука і один з радикалів H • одні і ті ж, ця різниця відображає тільки відмінність в стабільності первинного і вторинного радикалів. Подібне ж відмінність в енергії дисоціації изобутана (CH3) 3CH на (CH3) 2CH-CH2 • і H • (98 ккал / моль) і його ж дисоціації на (CH3) 3C • і H • (92 ккал / моль) відображає відмінність в стабільності первинного і третинного радикалів. На підставі цих даних можна скласти ряд відносної стабільності алкільних радикалів: стабільність алкільних радикалів знижується в ряду третинний> вторинний> первинний. Ще більш високою стабільністю мають аллільних і бензильний радикали, тоді як фенільний і вінільний радикали менш стабільні, ніж метил-радикал:
Зміна в стабільності алкільних радикалів зазвичай пов'язують з спільною дією двох ефектів - гіперкон'югаціі і стеричного. Якщо з радикальним центром пов'язаний заступник, що володіє мезомерним ефектом, то стабільність алкільного радикала в помітному ступені зростає. При цьому радикал стабілізується як сильними π-донорними (наприклад, - NH2), так і сильними π-акцепторними (наприклад, - BH2) групами, а також заступниками, які полегшують делокалізацію неспареного електрона (наприклад, - CH = CH2) в аллільном радикала. На стабільність алкільних радикалів впливають також пространственнние чинники. Прості алкільні радикали є майже плоскими частинками, в яких неспарених електронів займає майже негібрідізованную p-орбіталь.
Наприклад, в трет-бутильну радикала метильние групи відхиляються від площини всього на 20º. Отже, просторове відштовхування між заповненими електронними оболонками трьох метильних груп в ізобутані буде в значній мірі послаблюватися при дисоціації зв'язку C - H:
Якщо в якості запобіжного стабільності алкільного радикала ми виберемо енергію дисоціації зв'язку C - H в алканах, то зазначений просторовий ефект буде додатково до гіперкон'югаціі стабілізувати трет-бутильну радикал в порівнянні з метильних.
Зазвичай для вільних алкільних радикалів характерні реакції димеризації або диспропорционирования до алкана і алкена. наприклад:
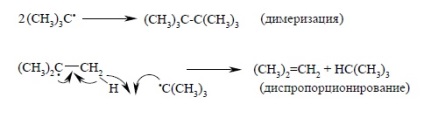
Оскільки обидві реакції бімолекулярні, просторові перешкоди в них повинні відігравати суттєву роль. Тому розгалужені алкільні радикали будуть менш схильні до загибелі і в цих реакціях.




