М'язове скорочення в живій системі це механохімічний процес. Сучасна наука вважає його найдосконалішою формою биоло-ня рухливості. Скорочення м'язового волокна біологічні об'єкти «розробили» як спосіб переміщення в просторі (що значно розширило їх життєві можливості).
М'язовому скороченню передує фаза напруги, яка є результатом роботи, що здійснюється шляхом перетворення енергії хімічної в механічну безпосередньо і з хорошим ККД (30-50%). Накопичення потенційної енергії в фазі напруги призводить м'яз в стан можливого, але ще не реалізованого скорочення.
У тварин і людини є (а людина вважає, що вже і непогано вивчені) два основних типи м'язів: поперечносмугасті і гладкіе.Поперечнополосатие м'язи або скелетні прикріплені до кісток (крім поперечносмугастих волокон серцевого м'яза, що відрізняються від скелетних м'язів і за складом). Гладкіемишци підтримують тканини внутрішніх органів і шкіру і утворюють мускулатуру стінок кровоносних судин, а також кишечника.
У біохімії спорту вивчають ську-льотні м'язи. «Конкретно відповідають» за спортивний результат.
М'яз (як макро освіту, що належить макро об'єкту) складається з окремих м'язових волокон (мікро утворень). У м'язі їх тисячі, відповідно, м'язове зусилля - величина інтегральна, підсумовує скорочення безлічі окремих волокон. Розрізняють м'язові волокна трьох типів: білі бистросокращающиеся, проміжні і червоні повільно скорочуються. Типи волокон розрізняються механиз-мом їх енергетичного забезпечення і управляються різними мотонейронами. Типи м'язів розрізняються співвідношенням типів волокон.
Окреме м'язове по-Локня - нитевидное біс-клітинне утворення - симпласт. На клітку симпласт «не схожий»: має сильно витягнуту форму в довжину від 0,1 до 2-3 см, в кравецькій м'язі до 12 см, і товщину - від 0,01 до 0,2 мм. Симпласт оточений оболоч-кою -сарколеммой, до поверхні якої підходять вікон-чення декількох рухових нервів. Сарколеммой - це двошаровий липопротеідна мембрана (товщиною 10 нм), укріплена мережею колагенових волокон. При розслабленні після скорочення вони повертають симпласт в вихідну форму (рис. 4).
Мал. 4. Окреме м'язове волокно.
На зовнішній поверхні сарколеми-мембрани завжди підтримується електричний мембранний потенціал, навіть в стані спокою він дорівнює 90-100 мВ. Наявність потенціалу є необхід-мим умовою для управління м'язовим волокном (як акумулятор для авто). Потенціал створюється за рахунок активного (значить з витратами енергії - АТФ) перенесення речовин через мембрану і її виборчої проникності (за принципом - «кого хочу - того і впущу, або випущу»). Тому всередині симпласта деякі іони і молекули накопичуються в більшій концентрації, ніж зовні.
Сарколеммой добре проникна для іонів К + - вони накап-ливаются всередині, а назовні виводяться іони Nа +. Відповідно, концентрація іонів Nа + в міжклітинної рідини більше, ніж концентрація іонів К + всередині симпласта. Зсув pH в кислу сторону (при утворенні молочної кислоти, наприклад) збільшує проникність сарколеми для високомолекулярних речовин (жир-них кислот, білків, полісахаридів), які в звичайному стані через неї не проходять. Легко проходять (дифундують) через мембрану низькомолекулярні речовини (глюкоза, молоч-ва і піровиноградна кислоти, кетонові тіла, амінокислоти, короткі пептиди).
Внутрішній вміст симпласта - саркоплазма - етоколлоідная білкова структура (по консистенції нагадує желе). У підвішеному стані в ній знаходяться включення глікогену, жирові краплі, в неї «вмонтовані» різні субкле-точні частки: ядра, мітохондрії, міофібрили, рибосоми та інші.
Скорочувальний «механізм» всередині симпласта -міофібрілли. Це тонкі (Ø 1 - 2 мкм) м'язові нитки, довгі - майже рівні довжині м'язового волокна. Встановлено, що в симпластах нетренованих м'язів міофібрили розташовуються не впорядковано, уздовж симпласта, але з розкидом і відхиленнями, а в тренованих - міофібірілли орієнтовані по поздовжній осі і ще згруповані в пучки як в канатах. (При прядінні штучних і синтетичних волокон макромолекули полімеру спочатку розташовуються не строго уздовж волокна і їх, як спортсменів, «наполегливо тренують» - орієнтують правильно - по осі волокон, шляхом багаторазового перемотування: дивись довжелезні цехи на ЗІВе і «Хімволокно»).
В світловий мікроскоп можна спостерігати, що міофібрили дійсно «поперечно смугасті». У них чергуються світлі і темні ділянки - диски. Темні диски А (анізотропні) білка містять більше, ніж світлі диски I (ізотропні). Світлі диски пересічені мембранами Z (телофрагма) і ділянку міофібрили між двома Z -мембранамі називаетсясаркомером. Миофибрилла складається з 1000 - 1200 саркомерів (рис. 5).
Скорочення м'язового волокна в цілому складається з скорочень едінічнихсаркомеров. Скорочуючи кожен окремо, саркомеривсе разом створюють інтегральне зусилля і виконують механічну роботу по скороченню м'язи.
Дли-на саркомера змінюється від 1,8 мкм в спокої до 1,5 мкм при помірному і до 1 мкм при повному скороченні. Диски саркомерів, темних і світлих, містять в собі протофібрілли (міофіламенти) - білкові ниткоподібні структури. Вони зустрічаються двох типів: товсті (Ø - 11 - 14 нм, довжиною - 1500 нм) і тонкі (Ø - 4 - 6 нм, довжиною - 1000 нм).
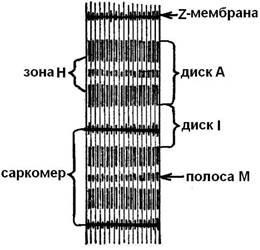
Мал. 5. Ділянка міофібрили.
Світлі диски (I) складаються тільки з тонких протофібрілл, а темні диски (А) - з протофібрілл двох видів: тонких, скріплених між собою мембраною, і товстих, зосереджених в окремій зоні (H).
При скороченні саркомера довжина темного диска (А) не змінюється, а довжина світлого диска (I) зменшується, оскільки тонкі протофібрілли (світлих дисків) вдвигаются в проміжки між товстими (темних дисків). На поверхні протофібрілл розташовані особливі вирости - спайки (товщиною близько 3 нм). В «робочому стані» вони утворюють зачеплення (поперечними містками) між товстими і тонкими нитками протофібрілл (рис. 6). При скороченні Z -мембрани впираються в кінці товстих про-тофібрілл, а тонкі протофібрілли можуть навіть накручуватися навколо товстих. При сверхсокращеніі кінці тонких ниток в центрі саркомера загортаються, а кінці товстих протофібрілл - мнуть.
Мал. 6. Формування спайки між актином і міозином.
Енергозабезпечення м'язових волокон здійснюється за допомогою саркоплазматической мережі (вона ж - саркоплазматический ретикулум) - системи поздовжніх і попе-річкових трубочок, мембран, бульбашок, відсіків.
У саркоплазматической мережі організовано і керовано протікають різні біохімічні процеси, мережа охоплює всі разом і кожну міофібрил окремо. Ретикулум включає рибосоми, вони здійснюють синтез білків, і мітохондрії - «клітинні енергетичні станції» (за визначенням шкільного підручника). Фактично мітохондрії вбудовані між миофибриллами, що створює оптимальні умови для енергетичного забезпечення процесу скорочення м'язи. Встановлено, що в тренованих м'язах число мітохондрій більше, ніж в тих же нетренованих.
Хімічний склад м'язів.
Вода з оставляет70 - 80% ваги м'язи.
Білки. На долюбелковпріходітся от17 до 21% ваги м'язи: приблизно 40% всіх м'язових білків зосереджені в миофибриллах, 30% - в саркоплазме, 14% - в мітохондріях, 15% - в антисарколемальних, інші в ядрах і інших клітинних орга-Неллі.
Безазотисті з'єднання. У м'язах містяться вуглеводи, глікоген і продукти його обміну, а також жири, холестерин, кетонові тіла, мінеральні солі. У зависи-мости від харчового раціону і ступеня тренованості кількість глікогену варіює від 0,2 до 3%, при цьому тренування збільшують масу вільного глікогену. Запасні жири в м'язах накопичуються в ході тренувань на витривалість. Пов'язаний з білками жир становить приблизно 1%, а в мембранах м'язового волокна може со-триматися до 0,2% холестерину.
Мінеральні речовини. Мінеральні речовини м'язової тканини складають приблизно 1 - 1,5% від ваги м'язи, це, в основному, солі калію, натрію, кальцію, магнію. Мінеральні іони, такі як К +. Nа +. Мg 2+. Са 2+. Сl -. НР04
грають найважливішу роль в біохімічних процесах при скороченні м'язів (їх включають до складу «спортивних» добавок і мінеральної води).
Біохімія м'язових білків.
Основний скоротливий білок м'язів - міозин відноситься кфібріллярним білків (Молекулярна маса близько 470000). Важлива особливість міозину - здатність утворювати комплекси з молекулами АТФ і АДФ (що дозволяє «відбирати» енергію у АТФ), і з білком - актином (що дає можливість утримувати скорочення).
Молекула міозину має негативний заряд і специфічно взаємодіє з іонами Са ++ і Мg ++. Міозин в присутності іонів Са ++ прискорює гідроліз АТФ, і, таким чином, виявляє ферментативну аденозінтріфосфатную активність:
Білок миозин утворений двома однаковими, довгими поліпептидними # 945; -ланцюг, закрученими як подвійна спіраль, рис.7. Під дією протеолітичних фер-ментів молекула міозину розпадається на дві частини. Одна з її частин здатна зв'язуватися за допомогою спайок з актином, утворюючи актоміозін. Ця частина відповідає за аденозінтріфосфатазную активність, яка залежить від рН середовища, оптимум - рН 6,0 - 9,5, а також концентрації КСl. Комплекс - актоміозін розпадається в присутності АТФ, але за відсутності вільної АТФ він стабільний. Друга частина молекули міозину теж складається з двох перекручених спіралей, за рахунок електростатичного заряду вони пов'язують молекули міозину в протофібрілли.
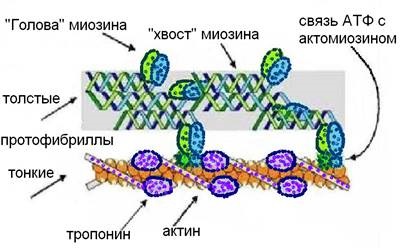
Мал. 7. Структура актомиозина.
Другий найважливіший скоротливий білок - актин (рис. 7). Він може сущест-вова в трьох формах: мономерной (глобулярної), димерной (глобулярної) і полімерної (фибриллярной). Мономерний глобуляр-ний актину, коли його поліпептидні ланцюги щільно укладені в компактну сферичну структуру, пов'язаний з АТФ. Розщеплюючи АТФ, мономери актину - А, утворюють димери, що включають АДФ: A - АДФ - A. Полімерний фібрилярний актин - подвійна спіраль, що складається з димарів, рис. 7.
Актин глобулярний переходить в фібрилярний в присутності іонів К +. Мg ++ і в живих м'язах переважає фібрилярний актин.
У миофибриллах міститься значна кількість білка тропомиозина. який со-стоїть з двох - # 945; -спіральні поліпептидних ланцюгів. У покояться м'язах він утворює комплекс з актином і блокує його активні центри, оскільки актин здатний зв'язуватися з іонами Са ++ вони і знімають цю блокаду.
На молекулярному рівні товсті і тонкі протофібрілли саркомера взаємодіють електростатично, так як мають особливі ділянки - вирости і виступи, де формується заряд. На ділянці А-диска товсті протофібрілли побудовані з пучка поздовжньо орієнтованих молекул міозину, тонкі протофібрілли розташовуються радіально навколо товстих, утворюючи структуру, схожу на багатожильний кабель. У центральній М-смузі товстих протофібрілл міозіновие молекули соеди-нени своїми «хвостами», а їх виступаючі «голови» - вирости спрямовані в різні боки і розташовані по пра-Вільно спіральним лініях. Фактично навпаки них в спіралях фибриллярного актину на певній відстані один від одного вбудовані мономерні глобули актину теж виступають. У кожному виступі імеетсяактівний центр, за рахунок якого можли-но утворення спайок з міозином. Z-мембрани саркомерів (як чергуються постаменти) скріплюють між собою тон-кі протофібрілли.