Природно, температура кипіння розчину двох речовин - води (t кип = 100 ° C при 760мм.рт.ст) і етанолу (t кип = 78,3 ° C при 760мм.рт.ст) повинна знаходиться між температурами кипіння індивідуальних речовин. Залежність температури насиченого водно-спиртового пара або температура кипіння (пароутворення) цієї бінарної суміші від концентрації спирту в парах Y представлена на рис.1.
Варто звернути увагу, що на цьому графіку існує деяка точка А з концентрацією 96,4% температура в якій навіть менше температури кипіння 100% -го етанолу.
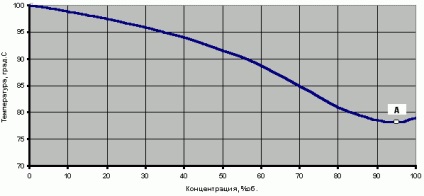
Рис.1 Температура насиченого водно-спиртового пара або температура кипіння водно-спиртової суміші (при тиску 760 мм рт.ст.)
Рівноважним станом фаз (рідкої і парообразной) називається таке їхнє співіснування, при якому не відбувається ніяких видимих якісних або кількісних змін цих фаз. Рівновага фаз вважається досягнутим тільки в тому випадку, коли одночасно задовольняються дві умови: рівні температури фаз і рівні парціальні тиску кожного компонента в паровій і рідкій фазах. Друга умова означає, що процес переходу через кордон розділу фаз кожного компонента з рідкої фази в парову фазу і назад завершено. Тобто склади рідкої і парової фази стабілізувалися, а концентрації компонентів в окремо взятій фазі однакові в кожній точці її обсягу.
Для бінарної водно-спиртової суміші це теоретичне висловлювання означає дуже просту річ. Якщо в звичайну колбу (схематично намальована всередині графіка рис.2) налити невелику кількість водно-спиртової суміші з концентрацією Xж і нагріти до температури кипіння цієї суміші, то в нинішньому парі концентрація спирту буде Yп. Потім, якщо швидко закрити колбу і інтенсивно струсити (перемішати парову і рідинну фази), то температура всередині колбочки вирівняється, а пар і рідина прийдуть в рівноважний стан - з концентраціями в них спирту Y иx відповідно.
Якщо такі досліди провести для різних концентрацій водно-спиртових розчинів, то можна отримати деяку залежність рівноваги фаз - крива рівноваги фаз. Графік кривої рівноваги фаз для бінарної суміші чистий спирт + чиста вода представлений на рис.2.
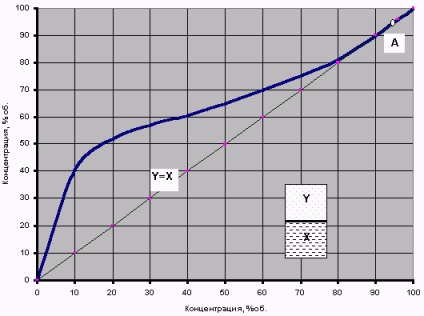
Рис.2 Крива рівноваги фаз бінарної водно-спиртової суміші
(При тиску 760 мм рт.ст.)
Теоретична і практична значущість кривої рівноваги фаз з точки зору процесу ректифікації спирту дуже велика, але до цього ми повернемося пізніше в розділі «Ректификация», а зараз покажемо, як цієї кривої користуватися.
Наприклад, при звичайній перегонці бражки з концентрацією спирту X = 10% утворюється пара з концентрацією в ньому спіртаY = 42%, а після його конденсації ми отримуємо «самогон» (конденсат, дистилят) тієї ж «фортеці». Таким чином, якщо самогонний апарат не забезпечений якимись додатковими «прибамбасами», то отримати більш міцний самогон таким способом теоретично просто неможливо. Таким же чином можна «передбачити» за допомогою тієї ж кривої і результат повторної перегонки «перваку» - з 40% -го дистиляту другій перегонкою можна отримати 60% -ий «самогон».
Розглядаючи цей графік, варто звернути увагу на діагональ Y = X. Саме завдяки тому, що майже вся крива рівноваги лежить вище цієї діагоналі, можна при випаровуванні водно-спиртової суміші отримувати концентрацію спирту в парах більшу, ніж його концентрація у вихідній рідини. Винятком є тільки точка А - перетин кривої рівноваги з діагоналлю, де X = Y = 96,4%. Це особлива точка азеотропа.
Азеотропними або нероздільно киплять називають суміші, у яких пар, що знаходиться в рівновазі з рідиною, має той же склад, що і рідка суміш (X = Y). При перегонці азеотропних сумішей утворюється конденсат того ж складу, що і вихідна суміш. Поділ таких сумішей перегонкою і ректифікацією виключається.
Водно-спиртова суміш в особливій точці азеотропа називається «етиловий спирт-ректифікат (СР)». Саме до цієї точки прагне процес ректифікації, саме вона є граничною концентрацією спирту в цьому процесі, і саме в цій точці водно-спиртова суміш має мінімальну температуру кипіння (t кип = 78,15 ° C при 760мм.рт.ст. См. Рис. 1).