Окислення сульфідів киснем повітря - необоротна екзотермічна реакція:
MeS + 1,5О2 = MeO + SO2.
При нагріванні сульфіду в повітрі з досягненням певної температури швидкість реакції стає настільки великою, що виділяється тепла достатньо не тільки для поповнення втрат тепла в навколишнє середовище, але і для підвищення температури окисляющегося сульфіду, що ще більше прискорює реакцію окислення. Ta температура, при досягненні якої процес окислення може протікати самостійно без підведення тепла ззовні, називається температурою займання сульфіду. Ця температура залежить від роду сульфіду і розмірів його зерен, причому у вищих сульфідів з більшою пружністю дисоціації вона нижче, ніж у нижчих сульфідів з малою пружністю дисоціації.
Швидкість процесу окислення твердого сульфіду киснем повітря визначається умовами дифузії газів через кірку твердих продуктів реакції, яка покриває ще незмінно сульфід в центральній ділянці зерна. Реакція тече на кордоні твердих фаз - сульфіду металу і твердого продукту реакції - оксиду металу, через шар якого всередину дифундує кисень, а назустріч йому - сірчистий газ. У міру окислення сульфіду швидкість просування фронту реакції сповільнюється, так як умови підведення кисню і відведення сірчистого газу через поступово товщає кірку окислів погіршуються. Час, необхідний для повного окислення зерна сульфіду, сильно зростає зі збільшенням розміру зерна.
Підвищення температури понад певної межі в багатьох випадках знижує швидкість окислення, якщо при підвищенні температури відбувається ущільнення - спікання кірки оксидів, що утрудняє дифузію. При окисленні сульфіду заліза підвищення температури вище 900 ° уповільнює окислення, так як вище 900 ° відбувається сильне ущільнення кірки оксидів заліза.
Окислення сульфідів киснем повітря є основною реакцією процесів випалу сульфідної сировини, що мають на меті часткове або повне видалення сульфідної сірки. В даний час випалу піддають тільки тонкозернисті порошки. Флотаційні концентрати досить тонкозернистого для швидкого окислення; компактні сульфідні матеріали, наприклад Файнштейн, перед випалюванням тонко подрібнюють.
Старий спосіб випалу полягає в окисленні киснем повітря шару порошку товщиною 50-100 мм, що лежить на поду обпалювальної печі. Так як досить швидко окислюються тільки частинки на поверхні шару, то матеріал перегребается особливим механізмом, чим досягається висновок з глибини на поверхню шару ще неокіслівшіхся частинок сульфідів, а також переміщення матеріалу назустріч току пічних газів. Випал на поду протікає повільно, апаратура громіздка і малопродуктивна. Для повного видалення сірки з сировини має витрачатися паливо внаслідок великих втрат тепла.
Нові інтенсивні способи випалювання здійснюють окислення так, що кожне зерно сировини під час випалу знаходиться в потоці гарячих газів, що містять кисень. При цьому створюються найбільш сприятливі умови для підведення кисню і відведення SO2 через кірку твердих продуктів окислення зерна сульфіду, і процес тече з максимальною швидкістю.
При випалюванні в підвішеному стані сухої сульфідні концентрат розпорошується повітряної форсункою в порожнину обпалювальної печі з розпеченими стінками.
При випалюванні в киплячому шарі розпечений товстий шар (500-1000 мм) порошку пекучого матеріалу на поду печі безперервно продувається повітрям через безліч дрібних отворів діаметром 2 мм в поду печі. Струмені повітря, пронизуючи шар пекучого матеріалу, створюють в ньому інтенсивні вихрові потоки, які надають шару вид киплячій рідини. Свіжий концентрат безперервно надходить в киплячий шар, а обпалений продукт безперервно же перекидається через пічної поріг, що обмежує висоту киплячого шару.
Інтенсивні способи випалу при багатому сіркою сировину не потребують сторонньому паливі і дають багаті SO2 гази. Значна частина продукції при цих умовах випалу несеться газами у вигляді пилу, для уловлювання якої повинні використовуватися високопродуктивні пилоуловлювальні системи.
Випал сульфідних матеріалів ведуть при надлишку повітря, так що газоподібний продукт випалу містить, поряд з SO2 і N2, значна кількість кисню. Кисень окисляє SO2 до сірчаного ангідриду з реакції SO2 + 1 / 2О2 = SO3. Ця реакція є основою отримання сірчаної кислоти контактним способом. Константа рівноваги реакції дисоціації сірчаного ангідриду
визначені з дуже великою точністю.
Чисельні значення KSO2 наведені нижче:
Наведені величини KSO2 свідчать про малу міцності SO3 при високих температурах. Згідно з правилом Ле-Шательє дисоціація SO3 збільшується при зниженні тиску. Це дуже суттєво для процесу випалу, при якому парціальні тиску SO3 в пічних газах не перевищують 0,1 ат.
Реакція синтезу SO3 сильно загальмована при низьких температурах. Платиновий каталізатор при виробництві сірчаної кислоти викликає утворення SO3 при 400 °, каталітична дія Fе2О3 ефективно при 600 °.
Склад пічних газів при випалюванні сульфідів змінюється зі зміною температури внаслідок утворення і розкладання SO3. Якщо газ до початку освіти SO3 мав парціальні тиску SO2 і О2 відповідно PSO3 і PO2, то внаслідок утворення SO3 з тиском PSO3 парціальні тиску SO2 і О2 зменшаться. Вони стають рівними pSO2 = PSO3 - pSO3. і pO2 = PO2 - 1 / 2pSO3, так як на освіту благаючи SO3 витрачається моль SO2 і половина благаючи О2. Для рівноважної системи тиску SO2, О2 і SO3 пов'язані виразом KSO3, що дозволяє розрахувати тиск SO3 в пічних газах (pSO3) П.Г. як рішення наступного рівняння щодо pSO3.
Присутність в випалювальних газах SO3 викликає при випалюванні сульфідів освіту сульфатів з оксидів металів.
Утворилися сульфати досить стійкі в окислювальному атмосфері і можуть перейти в кінцевий залишок. В одних випадках це небажано, якщо метою випалу є повне видалення сірки, в інших випадках - при випалюванні для подальшої гідрометалургійної обробки - освіту сульфатів корисно. Питання про умови утворення і розкладання сульфатів при випалюванні може бути дозволений, якщо є термодинамічні характеристики сульфатів.
Характеристикою сульфату може служити величина (# 916; Z0Т) образ сульфату з оксиду металу і сірчаного ангідриду з реакції
(Оксид) конд + (SO3) газ = (Сульфат) конд,
віднесена до одного молю витраченого SO3.
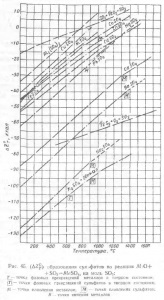
На рис. 45 наведені графіки температурної залежності (# 916; Z0Т) образ, для різних сульфатів разом з кривими (# 916; Z0Т) образ SO3 і SO2 на 1 моль продукту реакції.
Рівняння реакції утворення сульфату визначає форму вираження константи рівноваги реакції дисоціації сульфату Ксульф. = PSO2 величина (# 916; Z0Т) сульфіт - чисельне значення цієї константи:
Величини (# 916; Z0Т) сульфіт і Ксульф характеризують міцність хімічного зв'язку оксиду з SO3 - міцність сульфату. Чим більше значення цих величин, тим менше міцність сульфату.
Розглядаючи графіки (рис. 45), можна відзначити, що міцність сульфату збільшується зі зростанням основних властивостей оксиду, що утворює сульфат. Найміцніші сульфати утворюють оксиди лужних металів, менш міцні сульфати оксидів кальцію і барію, ще менш міцні сульфати двовалентних важких металів і самі нестійкі сульфати утворюються амфотерними оксидами Аl2Оз, Fе2О3.
Маючи в своєму розпорядженні характеристиками сульфату і складом пічних газів, можна вирішити питання про можливість або неможливість утворень сульфату так само, як вирішується питання про дисоціації сполуки в присутності продуктів дисоціації. Освіта сульфату можливо, якщо тиск газоподібного продукту дисоціації сульфату SO3 в атмосфері пічних газів над оксидом більше або дорівнює тиску SO3, що розвивається при дисоціації сульфату.
Сульфат утворюється, якщо (pSO3) П.Г.> (рSO3) сульфіт, в іншому випадку утворення сульфату неможливо, а вже утворився сульфат повинен розкладатися.
Практикою випалу встановлено, що утворення сульфатів сприяють високий вміст SO2 в продуктах випалу і низькі температури. Освіта сульфатів при випалюванні відзначається при температурах 500-650 °.
При випалюванні не можна уникнути утворення сульфатів, так як в певній стадії випалу будуть існувати умови, що сприяють сульфатізаціі. Якщо в продукті випалу не повинно залишатися сірки, то раніше утворилися сульфати повинні бути зруйновані підвищенням температури. Якщо при випалюванні температура підвищується настільки, що (pSO3) П.Г. стає менше (рSO3) сульфіт, то подальшу освіту сульфату припиняється, а вже утворився сульфат повільно розкладається з виділенням SO3. Для швидкого і повного руйнування сульфату необхідно підняти температуру настільки, щоб тиск газоподібних продуктів дисоціації сульфату перевищило зовнішній тиск.
Дисоціація сульфату на оксид і SO3 супроводжується значною дисоціацією SO3 на SO2 і кисень і процес дисоціації описується наступним рівнянням реакції:
а тиск продуктів реакції складається з тисків SO3, SO2 і О2:
Величина Ксульф = рSO3 дає тільки одну зі складових Рсульф - тиск SO3. При температурах помітного розкладання міцних сульфатів величина pSO3 становить лише невелику довго загального тиску продуктів реакції, так як SO3 сильно диссоциирован на SO2 і О2.
Тиску продуктів дисоціації сульфату SO3, SО2 і О2 пов'язані між собою виразом KSO3, а тиску SO2 і О2 - співвідношенням pO2 = 1 / 2pSO2, так як ці гази вийшли від розкладання SO3. Маючи в своєму розпорядженні величинами Ксульф і KSO3 для певної температури і використовуючи вищенаведені співвідношення між величинами pSO3, pSO2 і рО2, можна розрахувати величину загального тиску газів при дисоціації сульфату по формулі
Температуру, при якій Рсульф досягає величини 1 ат, називають температурою розкладання сульфату. Нагрівання продукту випалу - недогарка до цієї температури забезпечує швидке і повне розкладання раніше утворився сульфату.
Величину Pсульф легко визначити експериментально прямим вимірюванням тиску продуктів дисоціації сульфату. За величиною Рсульф і величиною KSO3 можна розрахувати парціальний тиск SO3, SO2 і O2, т. Е. Знайти по досвідченим даним константу дисоціації сульфату Ксульф. Для багатьох сульфатів є досвідчені дані температурної залежності величини Рсульф.
Температура розкладання сульфату значно нижча за температуру, при якій величина pSO3 при дисоціації сульфату досягає 1 ат. На графіках (див. Рис. 45) величиною pSO3 = 1 ат відповідає температура, при якій (# 916; Z0T) образ сульфату дорівнює нулю. Наприклад, (# 916; Z0T) образ CdSO4 дорівнює нулю при 1440 °, а -PCdSO4 = 1 ат при 1060 °; (# 916; Z0T) образ NiSO4 дорівнює нулю при 1050 °, а PNiSO4 = 1 ат при 890 °. Звідси випливає необхідність врахування дисоціації SO3 при розрахунках поведінки сульфату; недотримання цієї умови призводить до більших помилок у визначенні температури розкладання сульфату, тим більшим, чим вище міцність сульфату.
Температура розкладання сульфату знижується, якщо сульфат розкладається в присутності нелетучего кислотного оксиду, що дає міцне з'єднання з металевим оксидом сульфату. Наприклад, в присутності кремнекислоти сульфат кальцію розкладається по реакції
CaSO4 + SiO2 = CaSiO3 + SO3.
У цих умовах (# 916; Z0T) реакції розкладання CaSO4 за участю ЗSiO2 менше (# 916; Z0T) реакції розкладання CaSO4 без участі SiO2 на величину (Д2 °) реакції розкладання CaSiOs на CaO і SiO2. Звідси випливає, що дія ЗSiO2 на дисоціюють CaSO4 супроводжується підвищенням тиску SO3, а отже, зниженням температури розкладання сульфату.
При розкладанні сульфатів нижчих окислів металів, що утворюють також вищий оксид, реакція розкладання сульфату ускладнюється окисленням нижчого оксиду металу. Наприклад, реакція розкладання 2FeSO4 = Fе2О3 + SO3 + SO2 супроводжується окисленням FeO до Fе2О3.
Міцний сульфат срібла Ag2SO4 дисоціює за реакції Ag2SO4 = 2Ag + SO3 + 1 / 2О2 з одночасним розкладанням нестійкого оксиду срібла Ag2O на компоненти.
У цих випадках величини (# 916; Z0T) реакції не збігаються з (# 916; Z0T) образ сульфату і повинні бути розраховані з залученням термодинамічних функцій, що характеризують нові продукти процесу.
Звичайно, і в описаних випадках ускладнених реакцій розкладання сульфатів для розрахунку величини Рсульф і температури розкладання сульфату необхідно враховувати дисоціацію SO3 на SO2 і О2.
Між утворилися сульфатами і незмінно сульфідами можливі побічні реакції окислення сульфідів киснем сульфатів, наприклад ZnS + 3ZnSO4 = 4ZnO + 4SO2, і освіту металів, наприклад PbS + PbSO4 = 2Рb + 2SO2.
При відновленні сульфатів газоподібними і твердими відновниками можуть виходити різноманітні продукти в залежності від роду сульфату і температури. Міцні сульфати Na2SO4, CaSO4, BaSO4 при повільному відновленні утримують всю сірку, перетворюючись в сульфіди по реакції CaSO4 + 4СО = CaS + 4СO.
Розкладання хімічних сполук з повним видаленням летких складових є завданням одного з видів технологічного процесу КАЛЬЦИНУЮЧА випалу, який використовується для отримання CaO з вапняку, MgO з магнезиту, глинозему Al2O3 з гідроксиду алюмінію і т. П. У печах для кальцинації матеріал нагрівають до температури швидкого розкладання відповідних з'єднань: карбонатів, гідратів, потім продукт кальцинації охолоджують.
Розкладання з'єднань (карбонату, гідрату) у струмі пічних газів стає можливим, якщо тиск газоподібного продукту дисоціації сполуки (СО2, Н2О) стає більше, ніж парціальний тиск цього ж продукту в пічних газах. Однак поки тиск продукту дисоціації сполуки залишається менше загального тиску пічної атмосфери, швидкість дисоціації невелика і залежить від умов дифузії продуктів дисоціації в атмосферу пічних газів. При нагріванні до температури, при якій тиск газоподібних продуктів дисоціації робиться рівним або більшим за тиск пічної атмосфери, швидкість процесу стає незалежною від дифузійних факторів, і визначається тільки швидкістю підведення тепла, потрібного для ендотермічної реакції дисоціації сполуки.
Температура, при якій тиск газоподібних продуктів дисоціації сполуки досягає 1 ат, називається температурою розкладання сполуки. На відміну від сульфатів продукт дисоціації карбонатів і гідратів складається майже виключно з СО2 або H2O, так як ці міцні з'єднання при температурах кальцинації помітно не діссіціруют на свої складові.
На практиці КАЛЬЦИНУЮЧА випал проводять в шахтних і відбивних печах, т. Е. Під атмосферним тиском. Температура кальцинації повинна бути вище температури розкладання відповідного з'єднання - карбонату або гідроксиду.
При цьому умови кальцинації може піддаватися Крупнокускові матеріал. Тривалість процесу повинна бути достатньою для прогріву всієї маси шматка до температури розкладання відповідних з'єднань.