Рис.2. Розщеплення d-АТ в тераедріческом поле лігандів
Сума енергій АТ dg і d # 949; серій відповідно до закону збереження енергії дорівнює початковому значенню енергії Е0 вироджених орбіталей. Різниця між енергіями нових підрівнів називають енергією (інакше параметром) розщеплення. Величина енергії розщеплення для даного комплексообразователя визначається природою ліганда.
Для 3d-елементів експериментально встановлений так званий спектрохімічних ряд. в якому зліва направо чисельне значення # 916; монотонно зростає:
I -
<–N CS – (Підкреслять атом, безпосередньо пов'язаний з комплексоутворювачем) Ліганди лівій частині ряду (ліганди слабкого поля) викликають незначне розщеплення енергії d # 8209; підрівні. У цьому випадку величина # 916; не перевищує енергію взаємного відштовхування спарених електронів, що призводить до заповнення АТ електронами відповідно до правила Гунда (див. рис. 3).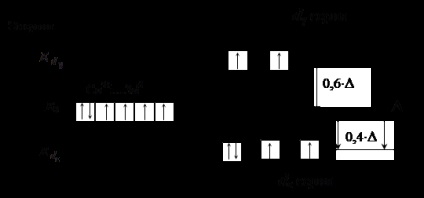
Рис.3. Розподіл електронів d -подуровня в іоні Co 3+ при
октаедричному розташуванні лігандів слабкого поля
Ліганди правій частині ряду (ліганди сильного поля) призводять до значного розщеплення енергії d -подуровня, при цьому величина # 916; перевищує енергію межелектронного відштовхування спарених електронів. Це означає, що енергетично більш вигідно заповнювати електронами АТ з порушенням правила Гунда. Наприклад, в разі октаедричного розташування лігандів сильного поля електрони будуть заповнювати АТ спочатку по одному, а потім по другому d # 949; серію, а потім в такому ж порядку d # 947; серію (див. рис.4). Для тетраедричного поля порядок буде зворотний.
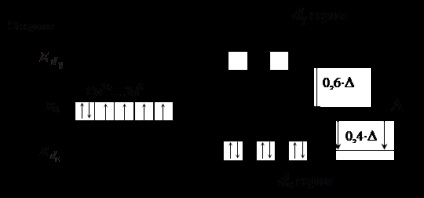
Рис.4. Розподіл електронів d -подуровня в іоні Co 3+ при
октаедричному розташуванні лігандів сильного поля
ТПЛ також як і МВС дозволяє пояснювати магнітні властивості комплексів: при наявності неспарених електронів - комплекс парамагнитен, а при їх відсутності - диамагнитен.
Якщо на d # 947; підрівні в разі октаедричного поля лігандів (або на d # 949; підрівні для тетраедричного поля) є вакантна (вільна) АТ, то при поглинанні комплексним іоном кванта світла можливий перехід електрона з нижнього енергетичного підрівня на. Такого роду переходи визначають наявність забарвлення у КС, так як енергія поглинається кванта світла дорівнює енергії розщеплення. У розрахунку на 1 моль поглинає речовини справедливо співвідношення (Дж / моль)
,
де h - постійна Планка (h = 6,63 × 10 -34 Дж × с); с - швидкість світла (с = 3 × 10 8 м / с); NА - постійна Авогадро (NА = 6, 02 × 10 23 моль -1); l - довжина хвилі світла, що поглинається, м.
При поглинанні світла з довжиною хвилі певної частини спектра, речовина виявляється забарвленим в відповідний колір. При заміні в комплексі одних лігандів на інші, що володіють більшою силою поля, значення # 916; зростає, і комплекс починає поглинати промені світла з меншою довжиною хвилі. Це змінює його забарвлення. Наприклад, у комплексів міді (II) при переході від [CuCl4] 2+ до [Cu (H2 O) 4] 4+ і до [Cu (NH3) 4] 2+ колір змінюється від зеленого через блакитний на синьо-фіолетовий.
При характеристиці стійкості комплексів використовують такі поняття, як стійкість і інертність або нестійкість і лабільність. Стійкість комплексу є його термодинамічної характеристикою і пов'язана з енергіями утворюються зв'язків і зі зміною ентропії при комплексообразовании. Інертність і, навпаки, лабільність комплексу є його кінетичними характеристиками, що залежать від швидкостей заміщення його лігандів. Стійкі комплекси можуть бути інертними і лабільними. Наприклад, іони [Cr (H2 O) 6] 3+ і [Fe (H2 O) 6] 3+ мають близькі значення енергії зв'язку, тобто мають майже однаковою стійкістю, але перший комплекс інертний і обмінює ліганди повільно, а другий лабилен, так як обмінює ліганди швидко. Нестійкі комплекси найчастіше є лабільними.
При розчиненні в воді КС, які мають зовнішню сферу, диссоциируют як сильні електроліти з утворенням комплексного іона, що складається з частинок внутрішньої сфери, і іонів зовнішньої сфери. Цей процес називається первинної дисоціацією. наприклад
Поряд з цим процесом, як правило, протікає оборотна ступінчаста дисоціація внутрішньої сфери, яку називають вторинної дисоціацією. Так для іона [Fe (CN) 6] 4 цей процес йде по наступних ступенів
перший ступінь [Fe (CN) 6] 4 ↔ CN - + [Fe (CN) 5] 3
другий ступінь [Fe (CN) 5] 3 ↔ CN - + [Fe (CN) 4] 2- і т.д.
Кількісною характеристикою міцності комплексного іона є константою рівноваги процесу вторинної дисоціації, яку називають константою нестійкості Кнест. Наприклад, для іона [Fe (CN) 6] 4 константи нестійкості першого і другого ступенів виражаються рівняннями
;
На практиці частіше користуються величиною загальної константи нестійкості Кнест. яка характеризує сумарне рівновагу вторинної дисоціації. Наприклад, для іона [Fe (CN) 6] 4
[Fe (CN) 6] 4 ↔ 6CN - + Fe 2+.
Кнест дорівнює добутку констант нестійкості всіх ступенів:
Іноді замість Кнест користуються зворотною величиною - констанойі стійкості Кущ
Якщо комплекси мають однакове число лігандів, то їх стійкість можна визначити по загальній константі нестійкості: чим менше Кнест. тим більше стійкий комплексний іон.
Зіставлення Кнест комплексів для реагенту і для продукту (при постійному КЧ) дозволяє встановити напрямок зміщення рівноваги реакції обміну лігандами в розчині. Наприклад для процесу
порівнявши Кнест іонів [PtCl4] 2- і [PtI4] 2. які дорівнюють 1 × 10 -16 і 1 × 10 -31 відповідно, видно, що комплексний іон - продукт набагато стійкіше комплексу - реагенту. Отже, рівновага такого процесу сильно зрушено вправо, тобто дана реакція протікає в прямому напрямку.
Приклади розв'язання задач
Приклад 1. Визначте заряд комплексоутворювача в з'єднанні [Co (NH3) 4 Cl2] NO2. Назвіть це з'єднання.
Зовнішня сфера КС складається з одного аніона NO. отже, заряд всій внутрішній сфери дорівнює +1, тобто [Co (NH3) 4 Cl2] +. Внутрішня сфера містить дві групи лігандів NH3 і Cl -. Ступінь окислення комплексоутворювача позначаємо через х і вирішуємо рівняння
+1 = 1 × х + 0 · 4 + 2 · (-1). Звідси х = +1.
Таким чином, КС є комплексним катіоном. Назва з'єднання: нітрит діхлоротетрааммін кобальту (+1).
Приклад 2. Чому іон [Cu (NH3) 2] + має лінійну будову?
Визначаємо заряд комплексоутворювача в даному комплексному іоні
+1 = 1 × х + 0 · 2. Звідси х = +1.
Електронна будова валентних підрівнів іона Cu + відповідає конфігурації 3d 10 4s 0 4р 0. Так як 3d - підрівень не містить вакансій, то в утворенні зв'язків з донорно-акцепторного механізму (як акцептора) з боку Cu + беруть участь одна 4s і одна 4p орбіталі , які гібрідізіруют по типу sp. Такому типу гібридизації (див. Табл. 1) відповідає лінійна будівля комплексу.
Приклад 3. Визначте тип гібридизації АО центрального іона і геометричну будову комплексу [HgCl4] 2.
Електронна конфігурація центрального іона Hg 2+. 5d 10 6s 0 6р 0. а електронно-графічна схема може бути представлена наступним чином
П'ять 3d-електронів повністю розподіляються на орбіталях 3d # 949; серії, так як енергія розщеплення, яка виникає при взаємодії з лігандами сильного поля, виявляється достатньою для максимального спарювання електронів. Вільні 3d. 4s і 4р- орбіталі піддаються d 2 sp 3-гібридизації і обумовлюють октаедричні структуру комплексу. Комплекс є парамагнетиком, тому що є один неспарених електронів

Приклад 5. Складіть енергетичну діаграму освіти зв'язків в комплексі [CrF4] - і вкажіть тип гібридизації.
Електронна формула Cr 3+. ... 3d 3 4s 0 4p 0 4d 0. монодентатно ліганди F - утворюють чотири # 963;-зв'язку, є лігандами слабкого поля і створюють тетраедричну поле
Вільні дві 3d. одна 4s і одна 4р АТ комплексообразователя гібрідізіруют по типу d 2 sp. в результаті утворюється парамагнетичний комплекс тетраедричних конфігурації.
Приклад 6. Поясніть, чому іон [CoF6] 3 парамагнетичний, а іон [Co (CN) 6] 3 діамагнітний.
Електронна формула комплексообразователя З 3+. ... 3d 6. У октаедричному поле лігандів F - (ліганд слабкого поля) відбувається незначне розщеплення d- підрівня, тому електрони заповнюють АТ відповідно до правила Гунда (див. Рис.3). В цьому випадку є чотири непарних електрона, тому іон [CoF6] 3 парамагнетичний. При утворенні іона [Co (CN) 6] 3 за участю ліганда сильного поля (іон CN -) енергія розщеплення d- підрівня буде настільки значна, що перевищить енергію межелектронного відштовхування спарених електронів. Електрони будуть заповнювати АТ іона З 3 + з порушенням правила Гунда (див. Рис.4). В цьому випадку всі електрони спарені, сам іон - діамагнітний.
Приклад 7. Для іона [Cr (H2 O) 6] 3+ енергія розщеплення дорівнює 167,2 кДж · моль -1. Яка забарвлення сполук хрому (III) у водних розчинах?
Для визначення забарвлення речовини визначимо довжину хвилі, при якій відбувається поглинання світла
Таким чином, іон [Cr (H2 O) 6] 3+ поглинає світло в червоній частині спектра, що відповідає забарвленню сполуки хрому (III) зеленого кольору.
Приклад 8. Встановіть, чи випаде осад сульфіду срібла (I) при температурі 25 ° С, якщо змішати рівні об'єми 0,001 М розчину [Ag (CN) 2] -, що містить однойменний ліганд CN- з концентрацією 0,12 моль / дм3, і розчину іона-осадителя S2- з концентрацією 3,5 · 10-3 М.
Процес дисоціації для даного іона можна представити схемою
а процес осадження можна записати так
2Ag + + S 2 ↔ Ag2 S¯.
Щоб визначити чи буде утворюватися осад необхідно розрахувати твір розчинності сульфіду срібла ПР (Ag2 S) за формулою
Для визначення концентрації іонів срібла запишемо вираз для константи нестійкості комплексного іона
За довідником вибираємо значення константи нестійкості комплексу [Ag (CN) 2] - (Кнест = 1 · 10 -21). тоді
Розрахуємо твір розчинності утворюється осаду
.
За довідником вибираємо табличне значення твори розчинності сульфіду срібла (ПР (Ag2 S) табл = 5,7 · 10 -51) і порівнюємо його з розрахунковим. оскільки ПРтабл <ПРрасчет. то из данного раствора осадок выпадает, так как соблюдается условие выпадения осадка.
Приклад 9. Обчисліть концентрацію іонів цинку в розчині тетраціаноцінката натрію з концентрацією 0,3 моль / дм 3 при надлишку ціанід-іонів в розчині дорівнює 0,01 моль / дм 3.
Первинна дисоціація протікає практично повністю за схемою
Вторинна дисоціація йде за рівнянням
Запишемо для даного процесу вираз константи нестійкості
За довідником знаходимо значення константи нестійкості даного іона (Кнест = 1,3 · 10 -17). Концентрація ціанід-іонів, що утворюються в результаті дисоціації комплексу, набагато менше концентрації введеного переповнені ситістю, а можна вважати, що [CN -] »0,01 моль / дм 3. тобто концентрацією іонів CN -. утворюються в результаті дисоціації, можна знехтувати. тоді
Енергетика хімічних процесів. 3
Короткі теоретичні відомості. 3
Приклади розв'язання задач. 10
Хімічна кінетика і рівновага. 17
Короткі теоретичні відомості. 17
Приклади розв'язання задач. 22
Комплексні сполуки. 28
Короткі теоретичні відомості. 28
Приклади розв'язання задач. 39