Визначивши число неспарених електронів в КС, з'ясовують ступінь окислення комплексоутворювача, тип гібридизації його орбіталей і, як наслідок, просторова будова.
Реакційна здатність КС обумовлена участю в гібридизації зовнішніх d-орбіталей і наявності у комплексообразователей вільних «внутрішніх» d-орбіталей. КС із зовнішнім гибридизацией - sp 3 d 2 більш реакційноздатні, ніж з КС з внутрішньої гибридизацией - d 2 sp 3 (наприклад, [Fe (H2 O) 6] 2+ і [Fe (CN) 6)] 4).
Розподіл електронів по d - АТ впливає на стійкість комплексів: найбільш стійкі (за інших рівних умов) комплекси з заповненими і наполовину заповненими підрівнями.
Таким чином, ТКП пояснює багато властивостей комплексів, пов'язаних із заповненням електронами "внутрішніх" d - АТ: стійкість, теплоти реакцій, магнітні властивості; вона успішно пророкує спектри (кольоровість) комплексів.
Недоліком ТКП є те, що вона погано враховує основний внесок в енергію зв'язків, що має зазвичай донорно-акцепторні природу. Тому одночасне застосування двох теорій - ТВС і ТКП - дає взаємно доповнюють відомості.
Теорія молекулярних орбіталей (ТМО) дозволяє отримати більш багату інформацію про будову і властивості комплексів (вона, зокрема, пояснює спектрохімічних ряд, що робить ТКП). Однак ТМО більше підходить для якісних описів і оцінок.
Таким чином, координаційними називаються хімічні сполуки різних типів і агрегатних станів зі стійкою координацією лігандів навколо центрального атома або іона, які утворюються з простіших вихідних структур щодо можливих для них механізмів взаємодії.
Комплексоутворення розширює можливий діапазон валентності, число зв'язків збільшується за рахунок залучення великої кількості електронів і незаповнених орбіталей.
7.2. Контрольні питання і завдання
1. Склад КС: комплексний іон, центральний атом, ліганди, координаційне число нейтрального атома. Внутрішня і зовнішня сфери КС.
2. Ступінь окислювання комплексообразователя і заряд комплексного ІЗА. Номенклатура КС. Назвіть: а) K [AuBr4], б) Na3 [Ag (S2 O3) 2], в) [Cr (H2 O) (NH3) 4 Br] Cl2. Вкажіть в них зовнішню і внутрішню звірити, комплексоутворювач, його ступінь окислення, заряд комплексного іона, ліганди.
3. Напишіть структурні формули КС: нітрату тетраамміномеді (II), хлориду дібромотетраамміноплатіни (IV), аммінопентахлороплатінат (IV) калію, тетраціаноцінкат (II) тетраамміномеді (II), тріхлоротріаммінокобальт. До якого типу належить кожне з комплексних сполук?
4. Уявіть координаційні формули наступних сполук: а) 3NaF · AlF3. б) NH4 Br · CuBr2 · 2NH3. в) CoCl2 · 4NH3 · H2 O, г) 2Ba (OH) 2 · Cu (OH) 2.
6. Які типи гібридизації спостерігаються в разі утворення КС? Наведіть приклади.
7. Константа нестійкості і константа стійкості КС. Способи руйнування КС.
8. Застосування КС в медицині і фармації.
Приклади розв'язання задач
Приклад 1. Визначте заряд комплексного іона, координаційне число (к.ч.) і ступінь окислення комплексоутворювача в сполуках: а) K4 [Fe (CN) 6]; б) Na [Ag (NO2) 2]. Представлені з'єднання назвіть.
Рішення. Заряд комплексного іона дорівнює заряду зовнішньої сфери, але протилежний за знаком. Координаційне число дорівнює числу лігандів. Ступінь окислення комплексоутворювача визначається так само, як ступінь окислення атома в будь-якому поєднанні.
Приклад 2. Напишіть вираз для константи нестійкості комплексу [Fe (CN) 6] 4.
Рішення. Комплексна сіль, будучи сильним електролітом, у водному розчині необоротно дисоціює на іони зовнішньої і внутрішньої сфер:
Комплексний іон дисоціює оборотно і в незначній мірі:
Цей процес характеризується константою нестійкості комплексу:
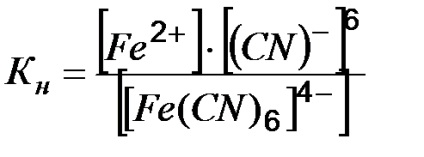
Чим менше Кн. тим більш міцний даний комплекс.
7.4. індивідуальні завдання
Завдання 1. Вирішіть завдання свого варіанту (табл. 47).
Варіанти контрольного завдання